Trichinella spp. (trikiner)
Huvudartikel, publicerad april 2011.
Till innehållsförtecknigen för Referensmetodik:Parasitologisk diagnostik
och
innehållsförteckningen för Referensmetodik:Smittskyddslagens sjukdomar
Trichinella spp. (trikiner)[redigera]
Smittämne[redigera]
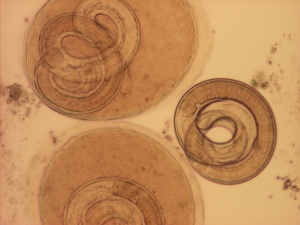
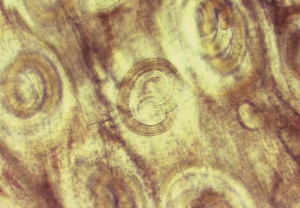
Trichinella är en rundmask som förekommer i alla världsdelar. Den kan infektera de flesta varmblodiga djur och är en av ett fåtal maskar vars hela utveckling sker i samma värd. Maskarna är trådlika och formar sig ofta som en spiral. De vuxna honmaskarna är cirka 3 mm x 0,06 mm och de vuxna hanmaskarna cirka 1,5 mm x 0,03 mm. Idag finns minst 9 arter, som bildar vävnadscystor i tvärstrimmig muskulatur, beskrivna: T. spiralis, T. nativa, T. britovi, T. nelsoni, T. murrelli, Trichinella T6, T8, T9 och T12 och tre arter som inte är cystbildare: T. pseudospiralis, T. papuae, och T. zimbabwensis (1, 2).
Livscykel[redigera]
Människan blir infekterad genom att äta kött (muskel) som innehåller cystor med det första larvstadiet. Cystväggen löses upp i magsäcken och de frisläppta larverna invaderar slemhinnan i tolvfingertarmen och tunntarmen och utvecklas där till vuxna maskar. Det tar cirka två dygn för maskarna att bli könsmogna efter infektionstillfället. Efter ytterligare cirka tre till fyra dygn kläcks äggen i parasitens uterus och det första av fyra larvstadier utsöndras. En honmask producerar mellan 200-2000 larver under sin livstid (2 månader). Larverna migrerar till lymf- och blodsystemet och penetrerar muskelcellerna. Inne i muskelcellen sker en strukturell reorganisation och en cysta (nurse cell) bildas. Larverna rullar ihop sig i cystan och ungefär 25 dagar efter smittan är de cirka 1 mm långa och infektiösa. Cystan mäter ca 0,4 mm x 0,26 mm och innehåller i regel endast en larv. Trikinlarven kan leva i cystan i många år och cystväggen förkalkas vanligtvis efter några månader. Cystor i kött är mycket resistenta och kan vara infektiösa flera månader i kadaver (1, 2, 3, 4).
Symtom och klinisk bild[redigera]
Gastrointestinala symtom kan förekomma några dagar efter intag av smittat kött. Under de första två veckorna efter infektion har tarmslemhinnan ökat blodflöde och inflammation orsakad av eosinofiler, mastocyter och lymfocyter samt små blödningar där masken penetrerat slemhinnan. Den viktigaste patogenesen orsakas dock av de migrerande systemiska muskellarverna som ger feber, ansiktssvullnader och muskelinflammation. Mest utsatta är aktiva muskler, t.ex. ögonmuskler och diafragma. Svullnaden avtar successivt efter femte veckan. Vid hög infektionsdos ses även symtom från hjärta, njurar och centrala nervsystemet. Eosinofili är det första kliniska tecknet och kan påvisas ca 10 dagar efter infektion; den når sin högsta nivå efter ca 3-4 veckor och börjar avta efter 9 veckor. Vid låg infektionsdos saknar den infekterade oftast symtom (2, 5).
Epidemiologi[redigera]
Trikininfektionen är kosmopolitisk och trikiner kan förekomma i kött framförallt från gris, rovdjur eller asätande djur. Infekterat hästkött har också orsakat trikinutbrott. I Sverige har T. spiralis, T. britovi, T. nativa och T. pseudospiralis påvisats.
Provtagning och transport[redigera]
Provmaterial[redigera]
Blod
Provtagning[redigera]
Prov i rör utan tillsats (serum) eller i EDTA-blodrör (plasma). Se provtagningsföreskrifter
Förvaring/transport[redigera]
Provet förvaras i rumstemperatur. För förvaring längre än 4 timmar placeras provet i kylskåp. Inga speciella krav för transporten.
Laboratoriediagnostik[redigera]
Allmänt[redigera]
Den serologiska diagnostiken (antikroppspåvisning i serum) är mest förekommande och tillförlitlig och anges referensmetodik. Trots att mikroskopisk påvisning av cystor med larver i muskulatur är den mest specifika metoden (och tillåter artbestämning av trikinen med PCR) rekommenderas den inte för primär humandiagnostik (2). Direkt påvisning av parasiten i muskelbiopsi är en invasiv och okänslig metod om inte en mycket hög infektionsdos föreligger. Cystor kan påvisas tidigast 4 veckor efter infektion.
Referensmetodik[redigera]
Antikroppsbestämning[redigera]
Oftast är metoderna inriktade mot detektion av IgG-antikroppar. ELISA utförs med antigen från muskelextraherade larver. Antikroppar kan påvisas mellan 2-5 veckor efter infektion: tiden för serokonversion är beroende på smittdos, trikinart och patientens immunsvar. Antikroppar kan påvisas hos de flesta patienter 2 år efter infektion (2). Vid IFL (indirekt immunfluorescens) används tunna snitt av muskellarver som antigen varvid specifika färgningsmönster kan urskiljas. Immunoblot är en annan serologisk metod som används för konfirmering vid fall av svårtolkat resultat i de andra metoderna (6).
Epidemiologisk typning[redigera]
Görs ej vid human diagnostik.
Kvalitetssäkring[redigera]
Det finns inget externt kvalitetskontrollprogram för trikin-serologi eller morfologi. I Italien finns ett internationellt referenslaboratorium för trikin-diagnostik i människor och djur (International Trichinella Reference Centre, Istituto Superiore di Sanità, Rom, Italien).
Svarsrutiner[redigera]
- Antikroppar påvisade (ev. ett värde/titer).
Kommentar: Antikroppssvaret talar för Trichinella-infektion.
- Inga antikroppar påvisade (ev. ett värde/titer).
Kommentar: Inga serologiska hållpunkter för Trichinella-infektion.
Laboratorierapportering[redigera]
Trikinos är klassad som en sjukdom utöver allmänfarliga sjukdomar enligt Smittskyddslagen 2004-168 och är både anmälningspliktig och smittspårningspliktig.
Referenser[redigera]
1. Muller R. Chapter 5: The Nematodes. Worms and Human Disease. Second edition (2002). CABI Publishing; 176-183.
2. Gottstein B, Pozio E, Nöckler K. Epidemiology, Diagnosis, Treatment, and Control of Trichinellosis. Clin. Microbiol. Reviews 2009;22(1):127-145.
3. Despommier DD. How does Trichinella make itself a home? Parasitol Today 1998;14:318-323.
4. Modha J. Roberts MC. et al. The surface coat of infective larvae of Trichinella spiralis. Parasitol.1999; 118:509-22.
5. Pozio E. Gomez Morales MA. Dupouy-Camet J. Clinical aspects, diagnosis and treatment of trichinellosis. Expert Rev Anti Infect Ther. 2003;1:471- 82.
6. Gamble HR, Pozio E, Bruschi F, Nöckler K, Kapel CMO, Gajadhar AA. International Commission on Trichinellosis: Recommendations on the use of Serological Tests for the Detection of Trichinella. Infections in Animals and Man. Parasite 2004;11(3):3-13.