Adenovirus-NLI
Huvudartikel
Till innehållsförteckningen för Referensmetodik: Nedre luftvägsinfektioner, 2:a upplagan 2005
Adenovirus[redigera]
Smittämnen[redigera]
Adenovirus är ett medelstort dubbelsträngat DNA-virus utan hölje. Viruspartikeln består av en ikosahedral kapsid med en diameter på 80 nm som omger arvsmassan på ca 35000 bp. Viruset är relativt stabilt och har en förmåga att överleva länge i vatten och fuktiga miljöer. Hittills har 51 olika serotyper av humana adenovirus identifierats, klassificerade i 6 olika subgrupper (species A-F). De olika serotyperna har mycket varierande biologiska och patologiska egenskaper vilket gör att adenovirus kan associeras med många olika kliniska syndrom.
Symtom och klinisk bild[redigera]
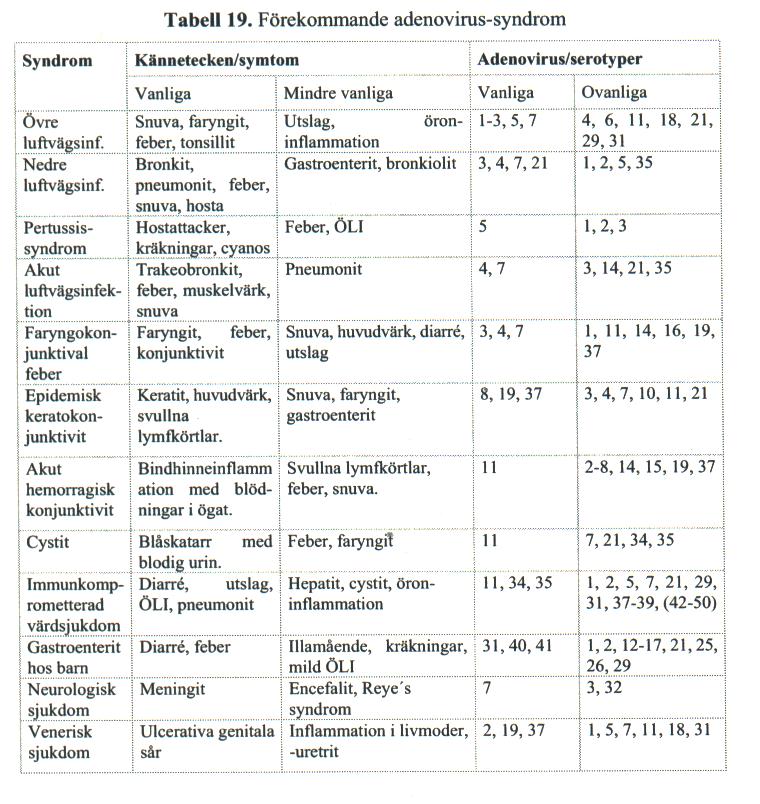
Adenovirus kan infektera epitelceller i luftvägar, ögon och troligtvis också tunntarm. Från dessa lokaler kan viruset sprida sig till lymfoid vävnad och ge upphov till långvariga kvardröjande infektioner i tonsiller och lymfkörtlar (Species C). Adenovirus ger vanligtvis upphov till akuta luftvägsinfektioner hos småbarn och förskolebarn. Hos förskolebarn förekommer huvudsakligen species C typerna 1, 2, 5, och 6 endemiskt vid dessa infektioner. Epidemiska utbrott av luftvägsinfektion (framförallt i skolor och militäranläggningar) orsakas främst av typ 3, 4, 7, 14 och 21. Nedre luftvägsinfektion, bronkit och pneumoni kan ses vid infektion med typ 3, 4, 7 och 21, samt undantagsvis också med typ 1, 2, 5 och 35. Andra sjukdomar som adenovirus ger upphov till är faryngokonjunktivit, feber, ögoninfektioner, akut cystit, gastroenterit samt meningit och encefalit. Ungefär hälften av de 51 adenovirustyperna ger upphov till sjukdom hos människa. Resterande hälft är ej vanligt förekommande och tycks inte heller ha någon större patogen effekt. De flesta adenovirusorsakade sjukdomarna är alltså relaterade till luftvägar eller ögon huvudsakligen i barnpopulationer. Dessa infektioner är oftast begränsade och inducerar en typspecifik immunitet följt av tillfrisknande. Men under de senaste åren har adenovirus även dokumenterats som orsak till en rad olika sjukdomar av mer allvarlig karaktär. Ett flertal fall har beskrivits av akuta luftvägsinfektioner hos spädbarn och små barn inkluderande hög feber och hjärt- och lungsvikt. Dessa ofta dödliga förlopp har associerats med typer tillhörande species B av adenovirus; vanligtvis typ 7 och genomvarianter av denna typ. Adenovirus tillhör också den grupp av virus som drar fördel av ett nedsatt immunförsvar och orsakar kvardröjande infektioner hos immunsupprimerade; infektioner som även kan ha ett dödligt förlopp.
Profylax och behandling[redigera]
Ingen specifik antiviral terapi riktad mot adenovirus finns tillgänglig idag. Hos patienter med nedtryckt immunsvar kan det vid svår adenovirusinfektion vara lämpligt (om så är möjligt) att minska på immunsupprimerande behandling.
Provtagning[redigera]
Provet tas med en fuktad bomullsarmerad pinne från svalg och konjunktiva, från bronksköljvätska (BAL-prov), men också inte att förglömma från feces även vid luftvägsinfektion. Vid en luftvägsinfektion behöver virus inte längre finnas kvar vid tidpunkten för provtagningen i svalget, medan det däremot vanligen utsöndras under betydligt längre tid i feces. Vid disseminering av infektionen till CNS skickas ca 0,5 mL ren likvor för PCR-analys. Vid svåra generaliserade infektioner, särskilt vid immunsuppression, kan virus-DNA påvisas i serum/plasma. I sådana fall rekommenderas ett rör EDTA-blod för PCR-analys. Pinnprovet transporteras lämpligen i någon form av virustransportmedium, medan fecesprovet kan skickas i fecesburk. BAL-provet skickas som det är i sterilt rör.
Laboratoriediagnostik[redigera]
Allmänt[redigera]
Vid adenovirusdiagnostik används både viruspåvisning (antigendetektion, virusodling samt PCR-amplifiering) och serologi.
Referensmetodik[redigera]
a) Virusodling : Virusodling på cellkultur är för närvarande referensmetod för påvisning av virus i svalgprov, BAL-prov, konjunktiva eller feces. A549-celler (human lungcancerlinje) ska alltid användas vid odlingsförsök även om humana fibroblaster och andra cellinjer är permissiva. Två typer av cytopatogen effekt uppträder vanligen efter 2-5 dagar; rundcellsdegeneration eller druvklasbildning. Rundcellsdegenerationen på A549-celler är till förväxling lik den vid herpes simplex-infektion. Druvklasbildningen är mer specifik för adenovirus och uppträder först i utlinjeringen av de hål i cellmattan som infektionen åstadkommer och i kanterna av cellmattan.
Identifieringen av isolatet görs enkelt med en direktmärkt fluorescerande antikropp riktad mot hexonproteinet – den medger således inte serotypbestämning.
Man kan också använda sig av snabbmetoder baserade på immunkromatografi eller latexagglutination. För serotypning se nedan.
Tabell 19[redigera]
Kommer senare
b) Antigendetektion: Antigendetektionen som metod är i regel för okänslig för direktpåvisning av antigen med immunfluorescensmetod, latex-agglutination eller immunkromatografi från luftvägsprover eller konjunktiva. Antigendetektionen lämpar sig i första hand för påvisning av antigen i feces och då särskilt av serotyperna 40/41, vilka kan utsöndras i stora mängder.
c) Nukleinsyrapåvisning: Adenovirus PCR-amplifiering har på senare år blivit allt viktigare som alternativ till odlingen. Hexongenen används oftast som målgen eftersom det är viktigt att rikta in sig på en konserverad region för att öka chansen till att alla 51 typer kan amplifieras med ett och samma primersystem. För ökad känslighet används ofta en nestad PCR, vilket innebär att amplifieringen sker i två separata steg med olika primerpar. Detta har visat sig vara viktigt för påvisande av viruspartiklar i likvor vid adenovirusorsakad encefalit, då koncentrationen av virus oftast är låg i denna kroppsvätska. Realtids-PCR har även börjat användas på större laboratorier inom landet. Denna teknik medför att man har möjlighet att kvantifiera antalet viruspartiklar i ett givet provmaterial. I väntan på specifika antivirala medel spelar antalet kopior ännu inte någon större roll ur klinisk synvinkel. Det kan dock vara av stort värde att följa adenovirusnivåerna hos immunsupprimerade patienter. Det har visat sig att adenovirus är vanligt förekommande i denna patientgrupp och mycket höga nivåer har uppmätts av många olika adenovirustyper i varierade provmaterial.
d) Serologi: Den klassiska komplementbindningsmetoden används fortfarande i Sverige för påvisande av ett immunsvar efter en adenovirusinfektion. För att säkerställa en infektion med metoden krävs akut- och konvalescentprov för att påvisa en signifikant titerförändring. Samma sak gäller för diagnostik med IgG-antikroppar. Förhöjda titrar i enstaka prov kan indikera en nyligen genomgången infektion. Av IgM-påvisning mot adenovirus finns ingen större klinisk erfarenhet. Vid en primärinfektion, som ju drabbar alla under småbarnsåren, finns ett IgM-svar, medan reinfektioner med samma eller andra serotyper ger inget eller svagt IgM. Därför har IgM-påvisningen en mindre betydelse hos äldre barn och vuxna. Serologin har en viktig plats i diagnostiken när man vill förvissa sig om huruvida påvisat virus haft en patogenetisk roll eller enbart varit en oskyldig passagerare – detta gäller särskilt när virus påvisats i fecesprov.
Epidemiologisk typning[redigera]
För att karakterisera adenovirus serotyper krävs att neutralisationstest utförs. Denna är tidskrävande och baseras på en kombination av virusodling på celler och neutralisering med typspecifika antikroppar. Det utförs endast på ett fåtal ställen i världen idag. Olika typer av genomkarakterisering på DNA-nivå har istället tagit över och idag talar man oftare om genotyper (med olika genomvarianter) än serotyper. Serotypning är dock fortfarande ”Gold-standard” och vid införande av en ny adenovirustyp måste denna typ vara definierad som serotyp. Karakterisering av adenovirustyper på genomnivå kan utföras på följande sätt :
- 1. Sekvensering av hela genomet.
- 2. Sekvensering av PCR-amplifierat fragment.
- 3. Restriktionsenzym analys av hela genomet.
- 4. Restriktionsenzym analys av PCR-fragment.
Metoderna 2-4 används idag i Sverige. Sekvensering av ett helt genom är tidskrävande och görs endast på forskningsnivå. Direktsekvensering av ett amplifierat och därmed begränsat fragment är snabbast och enklast. Det begränsas dock av att det i dagsläget bara finns runt 30 olika typspecifika hexonsekvenser tillgängliga i genbankerna att jämföra sin erhållna sekvens med. Framförallt för species D-gruppen saknas information och typning på detta sätt fungerar då ej fullt ut. Samma sak gäller för restriktionsenzymanalys av PCR-fragment. De 32 typer som tillhör species D går inte att skilja från varandra på grund av mycket hög DNA-sekvenshomologi i hexongenen. Att använda PCR-fragment som bas för typning av adenovirus kan vara lite motsägelsefullt. Först amplifieras en konserverad region upp som sedan skall vara måltavla för typspecifika olikheter. Trots detta går det med metod 4 att nästan fullständigt typa medlemmarna i övriga species (ABCEF). För fullständig typning på genomnivå används metod 3 då adenovirusspecifikt DNA prepareras för att i nästa steg klippas med olika restriktionsenzym. Genom att analysera klippt DNA på agarosgel går det att urskilja specifika bandmönster som är unika för varje typ. Med denna metod kan man även identifiera varianter av varje typ, så kallade genomvarianter. Det är oftast dessa varianter som figurerar ute i samhället beroende på att viruset har förändrat sig något sedan prototyperna, d.v.s. ursprungstyperna, isolerades och identifierades för första gången.
Kvalitetskontroll[redigera]
För närvarande finns inga kontrollpaneler tillgängliga. Inom Sverige utförs så kallade tre-lab-jämförelser.
Laboratorierapportering[redigera]
Adenovirusinfektion är ej anmälningspliktig.
REFERENSER[redigera]
- 1. Cardosa, M.J., S. Krishnan, P. Hooi Tio, D. Perera, and S. Chang Wong. 1999. Isolation of subgenus B adenovirus during a fatal outbreak of enterovirus 71-associated hand, foot, and mouth disease in Sibu, Sarawak. Lancet 354:987-991.
- 2. Mistchenko, A. S., J. F. Robaldo, F. C. Rosman, E. R. R. Koch, and A. Kajon. 1998. Fatal adenovirus infection associated with new genome type. J. Med. Virol. 54:233-236.
- 3. Pauschinger, M., N.E. Bowles, F.J .Fuentes-Garcia, V. Pham, U. Kuhl, P.L. Schwimmbeck, H.P. Schultheiss, and J.A. Towbin. 1999. Detection of adenoviral genome in the myocardium of adult patients with idiopathic left ventricular dysfunction. Circulation 10:1348-1354.
- 4. Hierholzer, J.C. 1992. Adenoviruses in the immunocompomised host. Clin. Microbiol. Rev. 5:262-274.
- 5. Walls, T., AG Shankar, and D. Shingadia. 2003. Adenovirus: an increasingly important pathogen in paediatric bone marrow transplant patients. Review in The Lancet Infectious Diseases. 3(2):79-86.
- 6. Heim, A., C. Ebnet, G. Harste, and P. Pring-Åkerblom. 2003. Rapid and quantitative detection of human adenovirus DNA by real-time PCR. J Med Virol 70:228-239.
- 7. Allard, A., B. Albinsson and G. Wadell. 2001. Rapid typing of human adenoviruses by a general PCR combined with restriction endonuclease analysis. J Clin Microbiol. 39:498-505.
- 8. Adrian, TH., G. Wadell, JC Hierholzer and R. Wigand. 1986. DNA restriction analysis of adenovirus prototypes 1 to 41. Arch. of Virology 91:277-290.