Bakteriella nedre luftvägsinfektioner-Odlingsmetodik
Till innehållsförteckningen för Referensmetodik: Nedre luftvägsinfektioner, 2:a upplagan 2005
Bakteriologisk diagnostik - Laboratoriemetodik
Provsättning[redigera]
Allmän odling[redigera]
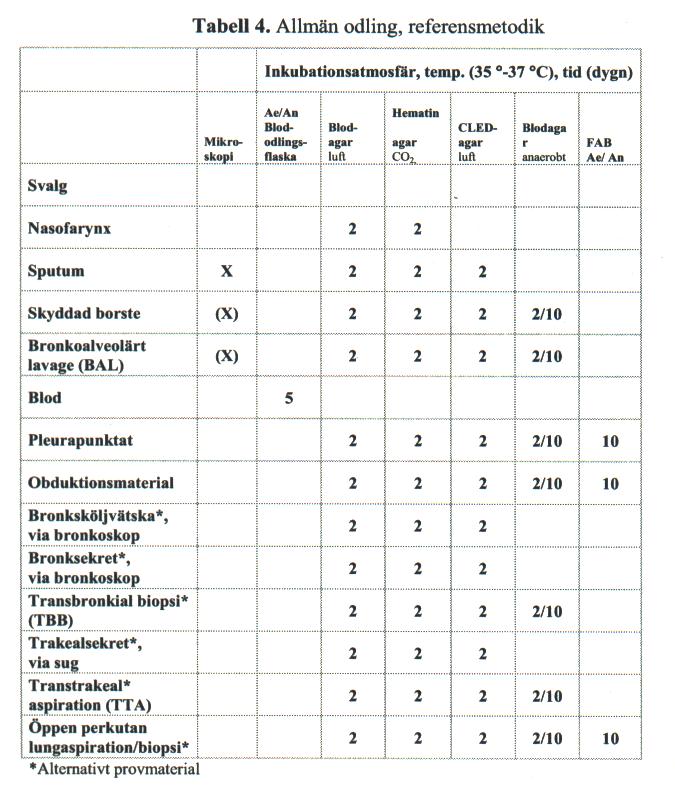
Val av medier, temperatur och inkubationstid beskrivs i tabell 4.
Inokulering av medier[redigera]
Allmänt[redigera]
Inokulera alltid medier i en bestämd ordning med i förekommande fall det minst selektiva mediet först. Provmaterialet kan kastas 3 dagar efter att provet slutsvarats.
- a) Inokulering med provtagningspinne
- Märk agarplattorna med LABNr och inokuleringsdatum.
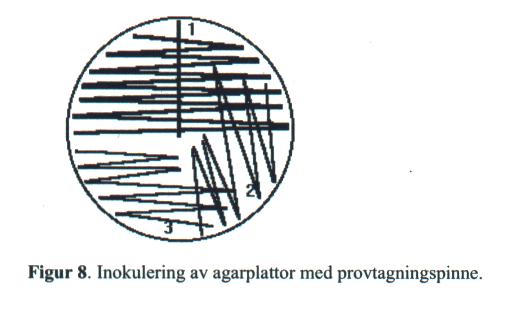
- Primärstryk agarplattorna med provtagningspinnen enligt figur 8.
Stryk först ett rakt stryk. Stryk sedan vinkelrätt mot detta första stryk. Rotera pinnen under hela stryket. Sekundärstryk med plastinös enligt 2 och 3.
Återställ provtagningspinnen i transportröret.
- b) Inokulering med flytande material
- Märk agarplattorna med LABNr och inokuleringsdatum.
- Applicera material till agarplattorna.
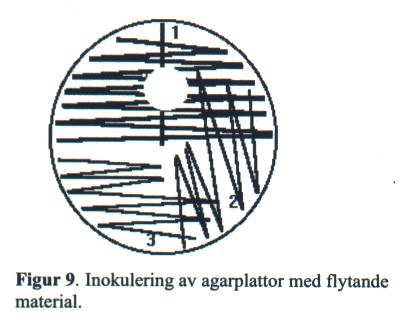
- Primärstryk agarplattorna med plastinös enligt 1, Fig 9.
Stryk först ett rakt stryk. Stryk sedan vinkelrätt mot detta första stryk. Sekundärstryk med plastinös enligt 2 och 3.
- c) Inokulering av flytande medier
- Märk buljongrör med LABNr och inokuleringsdatum.
- Ta provmaterial med engångsplast-automatpipett/sterila instrument och inokulera mediet.
d1) Tvättning av sputum inför kvantitativ odling
Skyddsåtgärder. Utförs i dragskåp med munskydd och handskar. OBS! Prov på patient med tbc- eller HIV- misstanke tvättas ej.
Tvättning utförs enbart på purulenta sputa.
- Häll sputum i en steril tesil.
- Spola med kranvatten. Observera att alltför kraftigt vattentryck kan medföra bortspolning även av representativt prov.
- Skölj med 0,9 % steril NaCl.
- Häll tillbaka provet i det NaCl-sköljda provtagningskärlet.
d2) Mikroskopi sputumprov
- Märk ett objektglas med LABnr.
- Tag med plastinös upp prov från den purulentaste delen.
- Stryk ut detta tunt på objektglaset.
- Låt lufttorka.
- Fixera över låga.
- Gramfärga.
d3) Kvantitativ odling, sputum
- Tillsätt arbetslösning av Sputolysin®Reagent, Cabiochem. (Generisk beteckning, dembrexinhydrokloridmonohydrat, en bensylamin med mukolytiska egenskaper) i lika stor mängd som provet.
- Skaka på Vortex i cirka 20 sekunder.
- Låt stå i rumstemperatur i 10 minuter.
- Odling av ospätt prov, se nedan under utodling.
Spädning av Sputolysinbehandlat sputumprov
- 10 μL prov (blå ögla) + 1 mL PBS (=spädning 1/100).
- Utodling
- Odla det ospädda sputolysinbehandlade och det spädda provet på respektive agarplattor med 10 μL/platta.
- För att ytterligare separera kolonier kan ytterligare spädning göras.
- Späd provet: 10 μL från första spädning till 1 mL PBS (=spädning 1/10 000).
- Utodla som ovan.
Märk medier med LABnr inokuleringsdag och spädning. Val av medier, atmosfär, temperatur och inkubationstid , se Tabell 4.
e) Kvantitativ odling, skyddad borste
- Borste i sterilt rör med 1 mL 0,9 % NaCl. Om borsten kommer i sterilt tomt glasrör: tillsätt 1 mL 0,9 % NaCl.
- Skaka på Vortex cirka 20 sekunder.
- Märk medier med LABnr och inokuleringsdag.
- Odla ut 100 μL (0,1 mL) på respektive agarplatta, rackla.
Ofta tas skyddad borste tillsammans med BAL. Det är då viktigt att den skyddade borsten tas först.
Vissa laboratorier erbjuder sig att ta hand om hela katetern med innesluten borste för vidare åtgärd.
f) Kvantitativ odling, BAL
Provet kommer i rör.
- Odla ut provet på respektive agarplatta med 10 μL ögla.
- Märk medier med LABnr och inokuleringsdag.
Ofta tas skyddad borste tillsammans med BAL. Det är då viktigt att den skyddade borsten tas först.
Provsättning riktad odling[redigera]
Bedömning av odlingsfynd[redigera]
Allmän odling[redigera]
- 1. Bedöm medierna med avseende på kvalitativ eller kvantitativ växt. Kvantitering av pinnprov är ej reproducerbar men kan användas i särskilda fall för att markera fåtal eller dominans. Använd gärna plattmikroskop.
- 2. Verifiera och resistensbestäm (ev.) följande isolat:
- Målbakterier i signifikant koncentration.
- Isolat som omfattas av smittskyddslagen.
- Fynd av övriga bakterier som på kliniska grunder bedöms ha betydelse för sjukdomsförloppet eller på grund av epidemiologiska skäl.
- Specifik frågeställning från den kliniskt ansvarige läkaren.
- 3. Karakterisera till gruppbeteckningsnivå eller beskriv makroskopiskt, resistensbestäm inte:
- Isolat vilka sannolikt tillhör den ordinära floran. Besvara som vanligen förekommande flora för provlokalen.
- Övriga fynd av ej vidare karakteriserade mikroorganismer eller lägre koncentrationer kan besvaras som t.ex. blandflora, orofaryngeal flora.
Om remissuppgifter saknas föreslås en kommentar och åtgärder enligt I 5, urinvägsinfektioner: ”Beslut om art- och resistensbestämning baseras på typ av prov och symtomatologi. Eftersom sådana uppgifter saknas har diagnostiken begränsats”.
Sputumprov[redigera]
Representativitet Om skivepitelceller från munhålan dominerar i provet, består detta framför allt av saliv. Innehåller provet ett stort antal leukocyter, tyder detta på en infektion. Om leukocyter till antal dominerar över skivepitelceller, anses detta tyda på att provet härrör från de djupa luftvägarna. Vissa patienter producerar enbart icke-purulenta sputa. Det förekommer framförallt hos immunsupprimerade patienter med lågt antal vita blodceller men även vid fall av pneumokockpneumoni.
- Bedömning av bakterieförekomst
- Lägg immersionsolja på objektglaset.
- Växla till 1000 x förstoring.
- Bedöm bakterieförekomsten.
Representativitetsbedömningen anges i slutrapporten.
Bedömning av odlingsfynd[redigera]
Svaret vid allmän odling bör alltid innehålla en beskrivning av gjorda fynd samt efter individuell bedömning, en kommentar. Svaret vid särskilda odlingar/ undersökningar ska innehålla information om sökt infektiöst agens (målbakterien/ antigen/ antikropp/ nukleinsyra) är påvisat eller ej, med angivande av detektionsmetod.
Bedömning av kvantitativ odling, sputum[redigera]
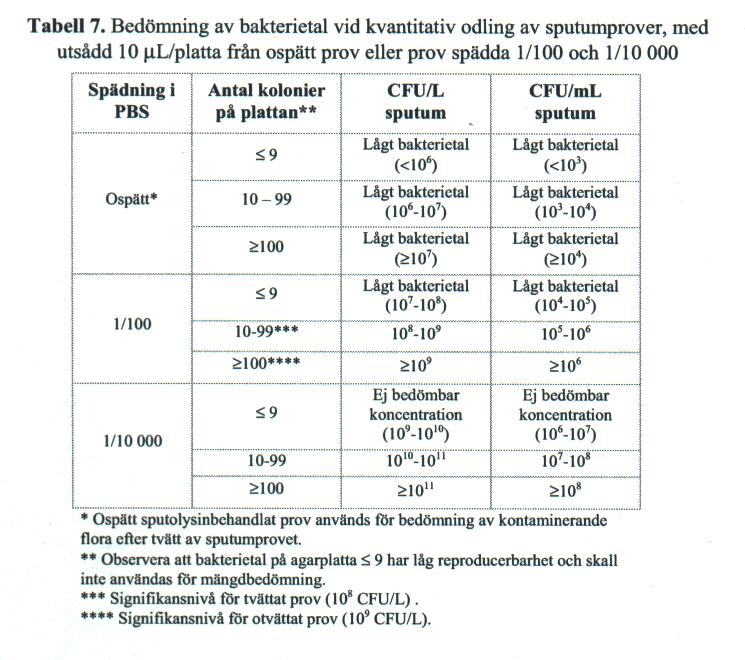
Räkna antalet bakteriekolonier på den platta det växer mest på. Läs av och för in masskoncentrationen enligt tabell 7 nedan.
Ange alltid representativitetsbedömningen i svarsrapporten.
Fynd av bakterier i signifikanta mängder besvaras med angivande av observerad koncentration. Lägre koncentrationer kan besvaras med koncentrationen och lågt bakterietal, efter särskild medicinsk bedömning.
Bedömning av kvantitativ odling, skyddad borste[redigera]
Alla bakteriefynd svaras. Fynd av bakterier i signifikanta mängder, d.v.s. >- CFU/L bronksekret besvaras med angivande av observerad koncentration (Tabell 8). Lägre koncentrationer kan besvaras med koncentrationen lågt bakterietal efter särskild medicinsk bedömning.
Lägre bakterietal kan föreligga i tidigt skede. Upprepade prov kan därför vara aktuella.
Bedömning av kvantitativ odling, BAL[redigera]
Olika författare anger därvid olika nivåer för cutoff-gränsen för optimal sensitivitet/specificitet. I tabell 9 har gränsen satts till CFU/L BAL-vätska motsvarande specificitet på 94 % och sensitivitet på 87 %. Teknik för ”skyddad” BAL med hjälp av kuffat bronkoskop har också utvecklats, men på grund av höga kostnader används denna teknik i endast ringa omfattning.
Alla bakteriefynd svaras. Fynd av bakterier i signifikanta mängder, d.v.s. > CFU/L BAL besvaras med angivande av observerad koncentration. Lägre koncentrationer kan besvaras med koncentrationen lågt bakterietal efter särkild medicinsk bedömning.
Anmärkningar
Lägre bakterietal kan föreligga i tidigt skede. Upprepade prov kan därför vara aktuella.