Bilaga 1: Substratrecept- Hud, mjukdelar, skelett och inre organ
Till innehållsförteckningen för Referensmetodik: Bakteriologisk diagnostik av infektioner i hud, mjukdelar, skelett och inre organ
Substratrecept[redigera]
Urvalet av referenssubstrat i denna gula bok har följt principen att finna medier som effektivast möjligt understödjer växt av beskrivna mikroorganismer. Alla laboratorier måste inte nödvändigtvis använda just dessa substrat, även om det genom inventerande EQUAS-utskick kan konstateras att så sker i många fall. De enskilda laboratoriernas substratval följer traditioner baserade på lokala erfarenheter, kunskaper och uppfattningar. Tanken är att referenssubstraten därvid skall utgöra valideringsgrund vid det lokala substratvalet. Ett problem vid sådana valsituationer är att olika fabrikat av ett substrat med synbarligen samma recept (eller olika recept för den delen) kan ha olika egenskaper och fungera mer eller mindre väl. Betydande batchvariationer förekommer också. Det är alltså lämpligt att t ex. inför en upphandling jämföra angivet referenssubstrat mot en uppsättning av alternativa substrat där det förra inte nödvändigtvis är det som visar sig ha de bästa egenskaperna.
För referenssubstraten anges firmanamn och katalognummer för spårbarhet till typrecept.
Näringsberikade fasta substrat för isolering av aeroba och fakultativt anaeroba bakterier (blodagar, hematinagar och CLED-agar)[redigera]
Till blod- och hematinagar används specialkomponerade blodagarbaser som finns kommersiellt tillgängliga. I dessa ingår ofta skonsamt enzymdigererat kasein som tillhandahåller peptider och aminosyror med lågt kolhydratinnehåll och bibehållen hög halt av tryptofan. Det senare möjliggör test av indolreaktion. Extrakt av köttprotein ger ytterligare aminosyror, vitaminer, spårelement etc. Dessa kom¬ponenter är definierade i US Pharmacopeia. Tillsatt autolysat av bakjäst bidrar till snabb tillväxt och ger substraten goda differentierande egenskaper. Majsstärkelse absorberar toxiska metaboliter inklusive fria fettsyror vilket bidrar till säker tillväxt. Ett generellt problem med blodagarbaser är det relativt höga innehållet av reducerande kolhydrater vilket negativt påverkar den hemolytiska kapaciteten hos betastreptokocker. Columbia blodagarbas enligt Ellner et al (1966) är speciellt komponerad för snabb tillväxt och differentiering och relationen mellan ingående peptoner har avvägts så att streptokockernas förmåga att producera betahemolysin optimerats. Columbia blodagarbas är därför lämplig som referensbas för blodagar.
Columbiablodagarbas och Blodagarbas II kan användas som bas för hematinagar (chokladiserad blodagar) avsedd att understödja växt också av Haemophilus- och Neisseria-arter. Emellertid utgör traditionellt Carpenter och Johnstons gc-agarbas grundmedium i hematinagar. Denna bas skiljer sig från andra blodagarbaser genom något mindre agarmängd och fosfatbuffring. I kombination med hemoglobin och andra tillväxtfaktorer erhålls ett mycket näringsrikt medium som innehåller bland annat bundet oxiderat hem (hematin, X-faktor) och NAD (V-faktor). Hematinplattor med Gc-agarbas utgör därmed referenssubstrat, vilka också, till skillnad från andra hematinagartyper kan användas för resistensbestämning av gonokocker.
1. Blodagar[redigera]
Indikation: Substrat anrikat med hästblod för isolering av ett stort antal typer av aeroba och fakultativt anaeroba mikroorganismer samt olika gramnegativa stavar, Neisseria (ej gonokocker), stafylokocker, pneumokocker och streptokocker från kliniska prov.
Princip: Columbia blodagarbas är ett välkomponerat grundmedium med bland annat kaseinhydrolysat och köttextrakt som kväve- och kolhydratkällor avsett att användas anrikat med 5-10 % valfritt blod. Vanligen används 5 % defibrinerat hästblod vilket ger distinkt betahemolys med olika streptokocker, vissa stammar av enterokocker och Listeria. Defibrinerat hästblod har ringa tendens att chelera metalljoner och ger ofta frodigare kolonier än om citratblod används. Många fabrikat av Columbia blodagarbas är inte avpassade för citratblod vilket också gäller referenssubstratet. Betahemolys orsakas av hemolys av de röda blodkropparna medan alfahemolys orsakas av att hemoglobinet i helt eller delvis intakta röda blodkroppar reduceras till methemoglobin. För blodagar avsedd för påvisande av betastreptokocker i svalgodlingar brukar istället 5-10 % fårblod rekommenderas, eftersom exempelvis enterokocker ofta inte ger betahemolys på sådant blod. Fårblod tenderar också att undertrycka normalflora, särskilt Haemophilus, mer än hästblod. Fårblodplattor kan gjutas dubbelskiktade för att underlätta avläsningen.
Växtkarakteristika: (se tabell 14).
På hästblodagar växer de flesta bakteriearter ut inom ett dygn. Kolonistorlek och utseende varierar kraftigt mellan olika arter trots att mediet inte i klassisk bemär¬kelse är differentierande. Flera bakteriearter uppvisar alfa- eller betahemolys, den senare med större säkerhet om plattorna inkuberas anaerobt. Ett flertal bakterietyper växer svagt eller inte alls på hästblodagar. Dit hör bland andra Haemophilus influenzae, Legionella och gonokocker.
- Recept: (Columbia blodagarbas, Acumedia no 7125)
- Innehåll---- Gram/L
- Pankreasdigererat kasein---- 5,0
- Köttextrakt---- 8,0
- Jästanrikad pepton--- 10,0
- Majsstärkelse---- 1,0
- NaCl---- 5,0
- Agar---- 14,0
pH 7,3 ± 0,2 vid 25 °C
Bered 5 % blodagar genom tillsats av sterilt, defibrinerat hästblod (alternativt fårblod, humanblod) enligt tillverkarens anvisningar.
2. Hematinagar (Chokladiserad blodagar)[redigera]
Indikation: Näringsberikat medium för isolering av gonokocker, meningokocker och Haemophilus influenzae från kliniska prov. Resistensbestämning av gonokocker.
Princip: Gc-agarbasbaserat medium som näringsberikas antingen med hemoglobin (torkat nötblod) och Isovitalex eller med hemolyserat hästblod och hästserum. Gc-agarbas utnyttjar som många andra blodagarbaser kaseinhydrolysat och köttextrakt som kväve- och kolhydratkälla. Reducerad agarmängd och fosfatbuffring bidrar till bättre och snabbare växt av framförallt gonokocker. Hemoglobin och Isovitalex (liksom lyserat hästblod och serum) tillför mediet bland annat X-faktor och V-faktor, en förutsättning för växt av H. influenzae, men bidrar också till god växt av Neisseria-arter. Hematinagar används också med tillsats av selekterande antibiotika (Modifierad Thayer-Martin-agar, VCNT-supplement) för isolering av gonokocker från kliniska prov. På grund av sitt innehåll av cystein stödjer substratet också växt av Francisella tularensis. Hematinagar och modifierad Thayer-Martin-agar kan därvid användas som alternativ till referenssubstratet Tularemiagar.
Växtkarakteristika: (se tabell 14).
Meningokocker, gonokocker och Haemophilus växer inom ett dygn med ”feta” blanka gråa kolonier, 0,5-2 mm. På hematinagar växer också inom ett dygn (ofta med kraftigare växt efter två dygn) pneumokocker och streptokocker med tydlig alfahemolys (gäller inte t.ex. GBS), stafylokocker (vita eller gulgråa kolonier), Listeria (stora matta platta kolonier) och ett flertal arter av gramnegativa stavar (stora ofta ”råa” kolonier). Candida albicans växer inom ett till två dygn med karakteristiskt ”stjärn-” formade vita, matta kolonier.
- Recept: (Gc-agarbas, Acumedia no 7104)
- Innehåll---- Gram/L
- Pankreasdigererat kasein---- 7,5
- Köttextrakt---- 7,5
- Majsstärkelse---- 1,0
- Di-kaliumfosfat---- 4,0
- Mono-kaliumfosfat---- 1,0
- NaCl---- 5,0
- Agar---- 10,0
pH 7,2 ± 0,2 vid 25 °C
Tillred hematinagar genom tillsats av hemoglobinpulver 10 g och IsoVitaleX 10,0 mL enligt tillverkarens anvisningar.
- Recept: IsoVitaleX (BBL, no 11876)
- Innehåll---- Gram/L
- Vitamin B12---- 0,1
- L-glutamin---- 10,0
- Adenin---- 1,0
- Guanin HCl---- 0,03
- p-Aminobensoesyra---- 0,013
- Nikotinamid-adenin-dinukleotid---- 0,25
- Tiamin pyrofosfat---- 0,1
- Järnnitrat---- 0,02
- Tiamin HCl---- 0,003
- L-cystein HCl---- 25,9
- L-cystin----- 1,1
- D-Glukos---- 100,0
3. Andra beredningsformer av blod- och hematinagar[redigera]
Ovanstående agarmedier utgör referenssubstrat. Dock kan andra beredningsformer förekomma på de enskilda laboratorierna. Det är därvid viktigt att validera dessa substrat mot referenssubstraten.
Blodagar:
Moderna kommersiella blodagarbaser har ofta goda egenskaper och är relativt likvärdiga. Alternativ till Columbia agarbas är Blodagarbas II. Det skall observeras att särskilt betahemolys kan påverkas beroende på vilken bas som väljs. Med Blodagarbas II erhålls utmärkt växt, men betahemolys kan bli odistinkt, dubbel, särskilt med fårblod.
- Recept: (Blodagarbas II, OX0ID, CM 271)
- Innehåll---- Gram/L
- Proteos pepton---- 15,0
- Digererad lever---- 2,5
- Jästextrakt---- 5,0
- NaCl---- 5,0
- Agar---- 12,0
pH 7,4 ± 0,2 vid 25 °C
Preparera 5 % blodagar genom tillsats av sterilt defibrinerat hästblod (alternativt fårblod, humanblod) enligt tillverkarens anvisningar.
Hematinagar:
Sådan agar kan tillverkas med vilken blodagarbas som helst. Det skall observeras att endast hematinagar baserad på gc-agarbas lämpar sig för resistensbestämning av gonokocker.
- Recept: Hematinagar (alternativ för isolering av H. influenzae och Neisseriae)
- Columbia blodagarbas med tillsats av:
- Hästblod i lösning---- 8,5 %
- Normalserum från häst 5-10 %
Tillverkas med chokladisering av blodet.
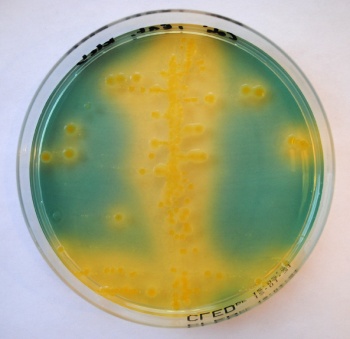
4. CLED-agar[redigera]
Indikation: Referenssubstrat för (i första hand) isolering av urinvägspatogener från urinprov, och Enterobacteriaceae vid allmän odling.
Princip: CLED är en förkortning av Cystein-Lactose-Electrolyt-Deficient utvecklat av Sandys och Mackey. Substratet är ickeinhibitoriskt men inte lika näringsrikt som blodagar. Innehåller såväl kaseinhydrolysat som köttextrakt och understödjer därmed växt av ett stort antal kliniskt relevanta bakterietyper. Karakteristiskt för detta substrat är avsaknaden av elektrolyter, vilket hindrar svärmning i första hand av Proteus. Mindre selektivt men för övrigt funktionellt nära saltfri McConkey-agar. Laktospositiva bakterier blir gula medan laktosnegtativa behåller mediets blåa grundfärg. Kontaminanter från urogenital flora (laktobaciller, mikrokocker och difteroider) växer ofta ut som mikrokolonier på plattan, vilket indikerar förorening.
Växtkarakteristika: (se tabell 14). E. coli och andra gramnegativa bakterier växer inom ett dygn med relativt stora (diameter >2mm), opaka, blanka, släta kolonier. Laktospositiva bakterier blir gulfärgade, ofta med gult färgomslag i substratet. Grampositiva bakterier som stafylokocker och enterokocker växer med mindre, ofta gula kolonier (diameter 1-2mm). Growth index för de flesta bakterietyper nära de för blodagar.
- Recept: CLED-agar (enligt Mackey och Sandys, OXOID CM301)
- Innehåll---- Gram/L
- Pepton---- 4,0
- ”Lab-Lemco” pulver---- 3,0
- Trypton---- 4,0
- Laktos---- 10,0
- L-cystein---- 0,128
- Bromtymolblått---- 0,02
- Agar---- 15,0
pH 7,3 ± 0,2 vid 25 °C
Generella och selektiva näringsberikade fasta substrat för isolering av anaeroba bakterier från kliniska prov[redigera]
De flesta typer av kliniskt relevanta anaeroba bakterier växer bra på substrat baserade på blodagarbaser (exempel är Blodagarbas II, Columbiaagar, Brain-heart-infusion-agar, Schaedleragar, Tryptic soy agar, Brucellaagar etc.) om dessa anrikats med 5-10 % häst- eller fårblod, hemin och menadion (vitamin K). Tillsats av cystein bidrar till att sänka redoxpotentialen. Eftersom sådan blodagar också understödjer växt av ett flertal fakultativt anaeroba bakteriearter kan små mängder anaeroba bakterier förbises. Det är därför ofta lämpligt att genom antibiotikatillsats eller, genom applikation av t. ex. metronidazol – och gentamicinlappar i primärstryket göra mediet selektivt för anaeroba bakterier. Alla dessa substratberedningar har relativt hög kolhydrathalt, varför betahemolys kan bli grönaktig. Brucellaagar är särskilt lämpad för isolering av gramnegativa stavar.
Tillredningen av dessa berikade blodagartyper är relativt komplicerad vilket kan medföra variationer i den fortlöpande tillverkningen. Fastidious anaerobe agar (FAA, LabM) har valts som referenssubstrat eftersom grundberedningen innehåller alla de tillväxtbefrämjande komponenter som beskrivs ovan. FAA har i kliniska utvärderingar visat sig likvärdig eller bättre än Columbia-agarbaserad blodagar eller brain-heart-infusionagar.
5. Anaerob blodagar (FAA)[redigera]
Indikation: Substrat avsett för primär isolering av flera typer av kliniskt relevanta anaeroba bakterier från kliniska prov.
Princip: Fastidious anaerobe agar (FAA) är en i grunden väl balanserad blodagarbas med speciell peptonmix som kväve- och främsta kolhydratkälla. Mediet innehåller stärkelse och bikarbonat vilka båda neutraliserar toxiska metaboliter. FAA innehåller också hemin och vitamin K, vilka utgör tillväxtfaktorer för ett flertal arter av anaeroba bakterier. Cystein sänker redoxpotentialen och pyruvat bidrar till neutralisering av väteperoxid. Substratet förstärks med 5 % hästblod, vilket förutom att bidra med ytterligare tillväxtfaktorer också möjliggör bedömning av hemolys.
Växtkarakteristika: se tabell 14.
- Recept: Fastidious anaerobe agar (FAA, LABM Lab 90)
- Innehåll---- Gram/L
- Peptonmix---- 23,0
- NaCl---- 5,0
- Stärkelse---- 1,0
- Agar no 2---- 12,0
- Na-bikarbonat---- 0,4
- Glukos---- 1,0
- Na-pyruvat---- 1,0
- Cystein HCl monohydrat---- 0,5
- Hemin---- 0,01
- Vitamin K---- 0,001
- L-arginin---- 1,0
- Pyrofosfat---- 0,25
- Na-succinat---- 0,5
pH 7,2 ± 0,2 vid 25 °C
Kontrollstammar: se tabell 14.
Tillred 5 % anaerob blodagar genom tillsats av sterilt defibrinerat hästblod enligt tillverkarens anvisningar.
Vid utvidgad anaerob diagnostik är bruk av selektiv anaerob blodagar, referensmetod. FAA och andra medier kan göras selektiva för anaeroba bakterier genom antibiotikatillsats. Traditionellt används ofta så kallad kanamycin (75 – 100 mg/L) –vankomycin (7,5 mg/L) –agar (referenssubstrat). Denna är selektiv för Bacteroides fragilis-gruppen och också lämpad för isolering av pigmenterade Prevotella species. Det skall dock observeras att flera Bacteroides-arter, Wolinella, fusobakterier, Bilophila och Porphyromonas liksom grampositiva anaerober ej växer på detta selektiva substrat. FAA med tillsats av neomycin, 100 mg/L (referenssubstrat) är särskilt lämpad för isolering av klostridier. Den inhiberar Enterobacteriaceae, men också vissa gramnegativa anaerober.
6. Andra beredningsformer av anaerob blodagar[redigera]
Ovanstående anaerob FAA-blodagar utgör referenssubstrat. Andra beredningsformer kan förekomma. Vid lot-inköp är det viktigt att validera alternativen mot referenssubstratet. Vanligt alternativ till FFA-agarbas är näringsberikad Brucella-agar med 5-10 % hästblod.
- Recept: (Brucellaagar, Acumedia no 7120)
- Innehåll---- Gram/L
- Digererat kasein---- 10,0
- Pepsindigererad djurvävnad---- 10,0
- Jästextrakt---- 2,0
- NaCl---- 5,0
- Glukos---- 1,0
- Na-bisulfit---- 0,1
- Agar---- 15,0
pH 7,2 ± 0,2 vid 25 °C
Bered anaerob blodagar genom tillsats av cysteinhydroklorid 0,5 g/L, hemin 5 mg/L och vitamin K 1 mg/L vid max 50 °C. Samtidigt tillsätts defibrinerat hästblod till 5 % i anaerob blodagar. Beredningen av selektiv agar som ovan för FAA.
Flytande substrat för anrikning av aeroba och anaeroba bakterier[redigera]
Dessa substrat är avsedda för mikrobiell anrikning av kliniska prov som innehåller få eller enstaka bakterier. Beredningarna är komponerade för att anrika flera olika typer av aeroba och anaeroba bakterier. ”Aeroba” buljonger kan ha kasein- och sojabönshydrolysat (Tryptic soy broth, TSB-buljong) som kväve- och kolhydratkälla. Alternativ är buljong baserad på pepton från köttextrakt (Nutrient broth nr2) eller infusion från hjärna och hjärta (brain-heart-infusion, BHI- buljong). Buljongerna understödjer växt av de flesta aerobt växande organismer utom Haemophilus och Neisseriae. Näringsberikning är därför nödvändig när dessa bakterier misstänks och anrikning önskas (ej referensmetodik). TSB berikad med Fildes supplement och inaktiverat hästserum rekommenderas (ej referenssubstrat). Fildes supplement utgörs av pepsindigererat, syra- och alkalibehandlat defibrinerat häst- eller fårblod, och innehåller ett flertal olika tillväxtfaktorer inklusive fritt hemin (X-faktor) och koenzym (V-faktor) för växt av Haemophilus och meningo- och gonokocker. Fritt hemin är toxiskt för streptokocker inklusive pneumokocker. Denna effekt neutraliseras genom tillsats av 5-10 % inaktiverat hästserum, motsvarande mängd albumin eller aktivt kol.
Det finns ett antal bra ”anaeroba” buljonger vilka dock inte är lämpade för anrikning av gonokocker och meningokocker (se ovan). Ett traditionellt basmedium som ofta rekommenderas är cooked meat medium (CM-buljong). Detta är särskilt effektivt för långtidsförvaring av anaeroba bakterier. Tyvärr är CM-buljongen även i kommersiella beredningar något komplicerad att bereda vilket kan leda till variationer i den fortlöpande tillverkningen. Växtsätt av olika bakterietyper framträder heller inte tydligt med denna buljong. Andra medier är Schaedler-buljong, näringsberikad BHI och olika typer av tioglykollatbuljonger där fastidious anaerobe broth (FAB, LabM) är i klass med CM-buljong och utgör referenssubstrat för anrikning av kliniska prov. Valet av denna buljong baseras bland annat på förmågan att anrika även anaeroba bakterier i aerob miljö och ett tydligt typrecept. FAB har i sin grundberedning tillsatser av L-cystein, Na-tioglykollat och en liten mängd agar som bidrar till att hålla buljongen tillräckligt anaerob även i aerob miljö.
7. Anaerob anrikningsbuljong (FAB)[redigera]
Indikation: För anrikning av ett stort antal kliniskt relevanta aeroba och anaeroba bakterier från kliniska prover och eventuellt transport av kliniska prover.
Princip: FAB är ett mycket näringsrikt substrat baserat på speciell peptonmixtur som kväve- och kolhydratkälla och med jästextrakt som näringstillskott. L-cystein och Na-tioglykollat bidrar till att reducera buljongen. Små mängder agar bidrar till att bibehålla anaerobios (redox-indikator resazurin, rosa färgomslag i översta buljongskiktet indikerar aerob miljö där men för övrigt anaerob miljö i röret). Till skillnad från andra tioglykollatbuljonger och CM-buljong är hemin och menadion tillsatta redan till grundberedningen. Trots goda egenskaper uppvisar FAB liksom övriga anaeroba buljongtyper ofta svag växt av fusobakterier och anaeroba grampositiva kocker, vilka kan kräva tre till sju dygns inkubationstid.
För optimal anaerobios rekommenderas i viss litteratur inkubering i anaerob miljö, men de flesta kliniskt relevanta anaeroba bakterier växer utmärkt även vid aerob inkubering. Därvid växer obligat anaeroba bakterier i rörets nedre del. Obligat aeroba bakterier växer bara i ytskiktet medan fakultativt anaeroba och aerotoleranta anaerober växer i hela buljongen.
Enterobacteriacae tenderar att svärma diffust i mediet medan de flesta andra bakterietyper växer utefter inokulationssticket eller intill provmaterialet. Neisseriae liksom vissa streptokockisolat växer dåligt eller inte alls.
Växtkarakteristika: Se bilaga 2 och tabell 14.
- Recept: Tioglykollatbuljong-FAB (LabM, LAB 71 )
- Innehåll---- Gram/L
- Peptonmixtur---- 5,0
- Jästextrakt---- 10,0
- NaCl---- 2,5
- L-cystein---- 0,5
- Na-tioglykollat---- 0,5
- Agar no 1---- 0,75
- Resazurin---- 0,001
- Na-bikarbonat---- 0,4
- Hemin---- 0,005
- Vitamin K---- 0,0005
pH 7,2 ± 0,2 vid 25 °C
8. Alternativ aerob anrikningsbuljong (TSB)[redigera]
Indikation: För anrikning av ett stort antal typer av aeroba och fakultativt anaeroba bakteriearter (utom Haemophilus, meningo- och gonokocker) från kliniska prov (ej referensmetod).
Princip: I sin grundberedning är TSB ett mycket näringsrikt medium som är lämpat för anriking av en mångfald olika bakterietyper i små mängder (i synnerhet streptokocker). Tillsats av Fildes supplement ger mediet tillgång till extra tillväxtfaktorer, inkluderande hemin (X-faktor) och koenzym (V-faktor). Därmed kan också små mängder av Haemophilus och meningo- och gonokocker anrikas inför sekundär utodling. Samtidig tillsats av inaktiverat 5-10 % hästserum är därvid nödvändig för att bibehålla buljongens generella egenskaper. Dessa tillsatser höjer dock priset avsevärt (ca 10-falt), varför anrikad buljong bara rekommenderas för situationer där sådana bakterier speciellt misstänks. Fildes supplement kan ersättas av 0,1-1 % Isovitalex och hemoglobin (innehåller bundet, därmed atoxiskt hematin) varvid serumtillsats ej är nödvändig.
- Recept: (Tryptic soy broth, TSB, Acumedia no 7164)
- Innehåll---- Gram/L
- Pankreasdigererat kasein---- 17,0
- Papaindigererat sojabönsmjöl---- 3,0
- NaCl---- 5,0
- Di-Kaliumfosfat---- 2,5
- Glukos---- 2,5
pH 7,3 ± 0,2 vid 25 °C
Vid beredning av näringsberikad TSB (”Fildes buljong”) tillsätts Fildes peptic digest of blood (Oxoid, SR46) 25-50 mL till 1000 mL TSB. Detta gör buljongen svagt ”rökfärgad” men fortfarande genomskinlig. Buljongen balanseras genom tillsats av inaktiverat hästserum 50-100 mL till 1000 mL TSB. Alternativt tillsätts 0,1-1,0 % Isovitalex (BBL) och 0,1-1,0 % bovint hemoglobinpulver (OXOID, L53).
Kontrollstammar: se tabell 14.
Övriga substrat[redigera]
9. Fenolmannitagar (FM-agar)[redigera]
Indikation: För isolering av stafylokocker från kliniska prov och preliminär identifiering av S. aureus (ej referensmetod i denna bok).
Princip: FM-agar (utan antibiotika) är modifierad efter G H Chapmans ursprungliga rekommendationer av agarmedium med hög salthalt för selektiv isolering av stafylokocker med differentiering av S. aureus genom dessas förmåga att jäsa mannit. Observera att även vissa stammar av koagulasnegativa stafylokocker kan jäsa mannit. Selektivitet för stafylokocker uppnås genom hög koncentration av NaCl (7,5 %), en nivå som utesluter växt av praktiskt taget alla övriga humanpatogena bakterier med undantag för Vibrio. Grundfärg ljust röd på grund av närvaro av indikatorn fenolrött. Vid jäsning av mannit gulfärgas kolonier och mediet runt dessa. Påvisande av gelatinhydrolys (Stone-reaktion på gelatinhaltigt medium) hos S. aureus kräver media med lägre salthalt (5,5 % NaCl, Chapman-Stone-medium).
Växtkarakteristika: S. aureus växer inom 24 tim med matta, släta gulvita kolonier ca 1 mm i diameter med gulfärgad zon i mediet runt kolonierna. Vissa stammar av koagulasnegativa stafylokocker kan ha samma växtsätt, men ofta är dessas kolonier vita. Föga växt av andra bakterietyper.
- Recept: Fenolmannitagar (Mannitol-Salt Agar, OXOID CM85)
- Innehåll---- Gram/L
- ”Lab-Lemco” pulver---- 1,0
- Pepton---- 10,0
- Mannit---- 10,0
- NaCl---- 75,0
- Fenolrött---- 0,025
- Agar---- 15,0
pH 7,5 ± 0,2 vid 25 °C
10. Selektiv fenolmannitagar (MS-agar)[redigera]
Indikation: Selektiv isolering av meticillinresistenta stafylokocker i kliniska prov.
Princip: Detta medium (MSA) skiljer sig från FM-agar genom lägre salthalt (3 %) för optimal sensitivitet avseende meticillinresistenta S. aureus. Selektivitet för stafylokocker bibehålls genom tillsats av litiumklorid som hämmar gramnegativa bakterier. Selektivitet för meticillinresistenta stafylokocker uppnås genom tillsats av t.ex. oxacillin 1 mg/L.
- Recept: Selektiv fenolmannitagar (Mast Diagnostic DM 160)
- Innehåll---- Gram/L
- NaCl---- 30,0
- Mannit---- 10,0
- Pepton---- 8,0
- Jästextrakt---- 2,0
- Laktalbumin---- 3,0
- Litiumklorid---- 7,0
- Glycin---- 1,0
- Na-pyruvat---- 3,0
- Fenolrött---- 0,025
- Agar---- 12,0
pH 7,4 ± 0,2 vid 25 °C
Selektiv fenolmannitagar bereds genom tillsats av t.ex. oxacillin (LabKemi, TAB/OX-0,1) 0,1 mg tabletter till 100 ml medium. Se för övriga aktuella rekomendationer RAFs hemsida [1]
11. Selektiv anrikningsbuljong för betahemolyserande streptokocker (här använd som ”GBS-buljong”)[redigera]
Indikation: För anrikning av GBS i pinnprov från vagina och andra lokaler samt från odlingar på nyfödda.
Princip: Todd-Hewitt-buljong (THB) formulerades ursprungligen för produktion av hemolysiner från streptokocker. Buljongen fungerar också utmärkt för anrikning av streptokocker och enterokocker och för odling inför serologisk gruppering. Detta näringsrika medium baserat på infusion av kött är speciellt buffrat för att bibehålla ett neutralt pH trots mikrobiell växt.
THB liksom vissa fasta substrat som Columbia blodagar och Islam-agar kan göras selektiv för betahemolyserande streptokocker genom tillsats av antibiotika. Vanligen tillsätts därvid gentamicin och nalidixinsyra (referensbuljongen). Vissa målbakterier inhiberas dock av denna kombination varför andra selektiva antibiotikakombinationer prövats. Kolistin och nalidixinsyra (LIM-buljong) rekommenderas därvid av CDC, men kombinationen Kolistin+oxolinsyra kan med fördel användas eftersom denna effektivt inhiberar även stafylokocker. För att optimera GBS-buljongen anger vi här reducerad mängd gentamicin 2 mg/L (istället för 8 mg/L) och nalidixin 15 mg/L.
- Recept: Todd-Hewitt-buljong (OXOID, CM 189)
- Innehåll---- Gram/L
- Infusion av kött---- 10,0
- Trypton---- 20,0
- Glukos---- 2,0
- NaCl---- 2,0
- Di-Na-fosfat---- 0,4
- Na-karbonat---- 2,0
pH 7,8 ± 0,2 vid 25 °C
THB-buljongen tillreds enligt tillverkarens anvisningar. GBS-buljong bereds genom tillsats av gentamicin 2 mg/L och nalixinsyra 15 mg/L. Alternativt ersätts gentamicin med Kolistinsulfat 10-13 mg/L. Nalidixin kan ersättas med oxolinsyra 5 mg/L. Eventuellt kan 5 % fårblod tillsättas för att ytterligare berika buljongen.
Kontrollstam : GBS CCUG 4208, se också tabell 14.
12. Selektiv anrikningsbuljong för vankomycinresistenta enterokocker (VRE) med vanA-gen[redigera]
Den beredning som ofta använts är identisk med den selektiva Todd-Hewitt buljong som beskrivs ovan som ”GBS”-buljong med användande av gentamicin (2 mg/L) och nalidixinsyra (15 mg/L). Selektivitet för VRE uppnås genom tillsats av vankomycin 32 mg/L. Observera att vankomycintillsatsen senare är ändrad till 4 mg/L (2012) så att buljongen även ska kunna selektera/anrika VRE med vanB-gen. Detta rekommenderas vid screening för VRE, se aktuell referensmetodik Vankomycinresistenta enterokocker (VRE), referensmetodik
Kontrollstammar: E. faecalis ATCC 29212 (vanko-S) och E. faecium CCUG 36804 (vanko-R, van A-typ). Se också tabell 14 och bilaga 2.
13. Transportsubstrat för bakteriologiska pinnprov[redigera]
Olika typer av transportsubstrat avsedda för kliniskt bakteriologiska prov tagna med fiberarmerad provtagningspinne finns kommersiellt tillgängliga.
Vi anger Amies kolade transportmedium (fabrikat Copan, Brescia, Italien) som referenssubstrat. Provtagningspinnarna är försedda med rayon (spunnen cellulosa)-tops och finns i olika grovlekar för olika provlokaler. I certifierad batchprövning ingår ett flertal bakteriearter med angiven överlevnadstid för ett flertal bakterietyper på minst 24 timmar.
- Recept: Amies kolade transportmedium, (Copan, Venturi Transystem, Brescia, Italien)
- Innehåll---- Gram/L
- Charcoal---- 10,0
- NaCl---- 3,0
- Na-vätefosfat---- 1,15
- K-dikvävefosfat---- 0,2
- KCl---- 0,2
- Na-tioglykollat---- 1,0
- CaCl2---- 0,1
- MgCl2---- 0,1
- Agar---- 4,0
pH 7,2 ± 0,2 vid 25 °C
REFERENSER[redigera]
- Blomgren E, Larsson M and Sjöberg L.. Comparative study of the bacteriological performance of commercial Amies agar swab transport devices with a traditional Stuart agar transport system. ASM 101st General meeting, Orlando, Florida. 2001. Poster session 29.
- Eley, A et al. Comparative growth of Bacteroides species in various anaerobic culture media. J Med Microbiol. 1985; 19: 195-201.
- Ellner, PD et al. A new culture medium for medical bacteriology. Am J Clin Pathol. 1966; 45: 502-504.
- Ganguli, LA et al. Evaluation of fastidious anaerobe broth as a blood culture medium. J Clin Pathol. 1982; 35: 458-461.
- Gästrin B, Kallings L O and Marcetic A. The survival time of different bacteria in various transport media. Acta Path Microbiol Scand. 1968; 74:371-380.
- Heginbothom, M et al. Comparison of solid media for cultivation of anaerobes. J Clin Pathol. 1990; 43: 253-6.
- Hunt G and Price, EH. Comparison of a homemade blood culture broth containing a papain digest of liver, with four commercially available…. J. Clin Pathol. 1982; 35: 1142-1149.
- Kahlmeter G / Smyth R 2000. [2]/MRB
- Mackey J P and and Sandys G H. Diagnosis of urinary Infections. BMJ. 1966; May: 1173
- Mason E O et al. Evaluation of four methods for detection of group B streptococcal colonization. J Clin Microbiol. 1976; 4: 429-431.
- Petts DN. Colistin-oxolinic acid-bloodagar: a new selective medium for streptococci. J Clin Microbiol. 1984; 19: 4-7.
- Stalons D R et al. Effect of Culture medium an Carbon dioxide concentration on growth of anaerobic bacteria commonly encountered in clinical specimens. Appl Microbiol. 1974; 27: 1098-1104.
- Thayer J. D. and Martin, J. E. Improved medium selective for cultivation of N. gonorrhoeae of N. meningitidis. Publ Health Reports. 1966; 81: 559-562.
- Waterworth, P. M. The stimulation and inhibition of the growth of Haemophilus influenzae on media containing blood. B J Exp Pathol. 1955; 36: 186-194.
- Welch, D. F. et al. Comparative evaluation of selective and nonselective culture techniques for isolation of group A beta-hemolytic streptococci. Am J Clin Pathol. 1991; 95: 587-590.