Bilaga 1a. Bakteriologiska referenssubstrat
Till innehållsförteckningen för Referensmetodik: Tarminfektioner, 2:a upplagan 2002
Substratbeskrivningar[redigera]
Salmonella/Shigella substrat[redigera]
Bilaga 1.1.1
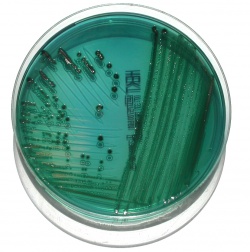
XLD-agar (Xylose-Lysin-Desoxycholat agar)
Indikation: Primärisolering av Salmonella och Shigella från humana fecesprov, samt utodling av Salmonella efter anrikning i buljong.
Princip: Väldefinierat substrat för isolering av Salmonella- och Shigella-bakterier. Substratets grundfärg är röd. Natriumdesoxycholat (1-2,5 gram/L) ger mediet måttlig selektiva egenskaper (särskilt hämmas grampositiva bakterier, men dessutom förhindras svärmning av Proteus species), utan att hämma Salmonella- eller Shigella-bakterier i någon högre grad. Indikatorsystemet utnyttjar de pH-förändringar som uppstår vid olika grader av syraproduktion från sockerfermentation (laktos, xylos, sackaros) och samtidig alkaliproduktion genom lysindekarboxylation. Shigella, Proteus och Pseudomonas producerar varken syra eller alkali i systemet och växer därför i färglösa semiopaka kolonier (kolonierna framstår som röda mot mediets grundfärg). Salmonella-bakterier är oftast LD-positiva men kan bara fermentera xylos, vilket ger en övervägande basisk reaktion. Övriga koliforma bakterier växer med gula eller vita opaka kolonier p.g.a. sänkt pH vid fermentation av laktos och sackaros.
Produktion av H2S kan inte förekomma i sur miljö, varför sådan produktion enbart detekteras för vissa bakterietyper (företrädesvis Salmonella, Proteus, Edwardsiella och Citrobacter) och ger därvid upphov till centralt svarta kolonier. Observera att vid inkuberingstider > 24 tim kan mediets egenskaper förändras, och därmed påverka differentierande kolonikarakteristika.
Växtkarakteristika: Salmonella-bakterier växer inom ett dygn som regel med growth index (GI) jämfört mot blod eller CLED-agar överstigande 50 %. Kolonierna är semiopaka, släta, blanka och färglösa (framstår röda mot mediets grundfärg). Kolonierna är ofta stora med diameter >2 mm och har ett distinkt svart centrum. Observera att atypiska LD-negativa eller laktosjäsande Salmonella, i likhet med andra koliforma bakterier, kan växa med gulfärgade, opaka kolonier. Observera att S. Typhi sällan blir H2S-positiv på XLD. Shigella-bakterier växer inom ett dygn med semiopaka, släta och blanka färglösa kolonier (framstår röda mot mediets grundfärg). Råa kolonier med ojämna kanter kan förekomma. Shigella växer i allmänhet med lägre GI än Salmonella, vissa stammar växer inte alls. Yersinia-arter växer inom ett (två) dygn med relativt små kolonier (0,5-2 mm diameter). Kolonierna är opaka och gul/vita.
XLD-plattor hämmar växt av E. coli och enterokocker ofta med en faktor > . Särskilt Proteus-, Citrobacter-, Pseudomonas- och Aeromonas-arter hämmas dock endast i ringa mån jämfört med icke inhibitoriska media. Den måttliga hämningen av normalfloran riskerar att maskera växt av målbakterierna, varför substratet inte lämpar sig som enda substrat för primärisolering. Däremot är substratet väl lämpat för utodling efter buljonganrikning.
Recept: (XLD-agar, Acumedia no 7166)[redigera]
- Innehåll--- Gram/L
- Xylos--- 3,5
- L-lysin--- 5,0
- Laktos--- 7,5
- Sackaros--- 7,5
- NaCl--- 5,0
- Jästextrakt--- 3,0
- Fenolrött--- 0,08
- Agar No 2--- 12,0
- Natriumdesoxycholat--- 2,5
- Natriumtiosulfat--- 6,8
- Ferriammoniumsulfat--- 0,8
pH 7,4 + 0,2
Bilaga 1.1.2
DC-agar enligt Hynes´ modifikation (desoxycholat, citrat, laktos-agar)
Indikation: För primärisolering av Salmonella och Shigella från humana fecesprov.
Princip: Jämfört med Leifsons DC-agar ger Hynes´ modifierade DC-agar effektivare inhibition av normalflora utan att negativt påverka växt av Salmonella och Shigella. Substratets grundfärg är blekt ”aprikosröd”. Substratet har goda selektiva egenskaper. En relativt hög koncentration av natriumdesoxycholat (5 gram/L) och natriumcitrat (8,5 gram/L) ger en effektiv inhibition av flertalet bakterier ur normalfloran. Indikatorsystem innefattar laktos och neutralrött. Natriumtiosulfat och järnammoniumcitrat utgör indikatorer för H2S-produktion. Laktosfermenterande koliforma bakterier producerar syra, vilket resulterar i rosa/röda opaka kolonier, ofta med en opak zon i mediet p.g.a. utfällda gallsalter. Sent laktospositiva eller laktosnegativa bakterier blir blekt rosa/röda eller färglösa, ibland kan en gul-orange zon i mediet förekomma beroende på en basisk reaktion. H2S-producerande bakterier kan ha grått eller svart kolonicentrum.
Växtkarakteristika: Salmonella-bakterier växer inom två dygn med GI överstigande 50 % jämfört med icke selektivt substrat i de allra flesta fall. Kolonierna är därvid semiopaka, blanka, färglösa, och mer än hälften av fallen med grått eller svart centrum. De flesta stammarna växer ut redan inom ett dygn. Kolonidiametern är ofta mindre än motsvarande på XLD. Shigella-bakterier växer inom två dygn (ca 1/3 av stammar har inte växt ut efter ett dygn) med relativt låga GI-värden, ofta mindre än 50 %, upp till 20 % av stammar som växer på icke inhibitoriskt substrat eller på XLD uppvisar mycket dålig eller ingen växt. Kolonierna är semiopaka, släta eller råa, färglösa (ibland rosa/röda opaka). Centralt upphöjda (”stekt ägg”) kolonier förekommer. Yersinia-bakterier (Y. enterocolitica och vissa stammar av Y. pseudotuberculosis, men även andra icke humanpatogena Yersinia-bakterier) växer inom två dygn med små kolonier med ungefär samma GI som Shigella. Kolonierna är färglösa, ibland blekt rosa/röda. E. coli och enterokocker hämmas ofta med en faktor >. Proteus-, Citrobacter-, Aeromonas-, Plesiomonas-och Pseudomonas-arter kan växa, om än i mindre omfattning än på XLD-agar. Proteus uppvisar ofta grått eller svart kolonicentrum. Den kraftigare hämningen av normalfloran jämfört med XLD gör substratet till ett bra komplement vid primärdiagnostiken, trots den lägre sensitiviteten för målbakterierna, särskilt Shigella.
Recept: (DC-agar enligt Hynes, Oxoid CM227)[redigera]
- Innehåll---- Gram/L
- ´Lab-Lemco´ pulver---- 5,0
- Pepton---- 5,0
- Laktos---- 10,0
- Natriumcitrat---- 8,5
- Natriumtiosulfat---- 5,4
- Järnammoniumcitrat---- 1,0
- Natriumdesoxycholat---- 5,0
- Neutralrött---- 0,02
- Agar---- 12,0
pH 7,3 + 0,2
Bilaga 1.1.3
Andra agarbaserade substrat för isolering av Salmonella/Shigella
Ovanstående agarmedier utgör referenssubstrat vid diagnostik av Salmonella- och Shigella-bakterier. Bland övriga på marknaden förekommande fasta substrat som ibland användes kan nämnas:
Hektoen-agar är lika selektiv och för övrigt med egenskaper påminnande om XLD. Med detta avses bl.a. att Salmonella-, Shigella- och Yersinia-bakterier växer med ungefär samma GI på dessa substrat som på XLD. Substratet är dock mindre väldokumenterat än XLD och DC-agar. Substratet har en grön grundfärg. Hög peptonhalt. Använder gallsalter för hämning av normalflorans bakterier. Understödjer växt av såväl Salmonella- som Shigella-bakterier. Salmonella växer med gröna kolonier med eller utan svart centrum. Shigella växer med gröna, genomskinliga ofta platta kolonier. Yersinia och koliforma bakterier växer med laxröda till oranga kolonier, ofta omgivna av en opak zon i mediet (utfällda gallsalter). Acceptabelt som alternativ till i första hand XLD-agar.
Recept: (Hektoen-agar, Oxoid CM419)[redigera]
- Innehåll---- Gram/L
- Proteospepton---- 12,0
- Jästextrakt---- 3,0
- Laktos---- 12,0
- Sackaros---- 12,0
- Salicin---- 2,0
- Gallsalter---- 9,0
- Natriumklorid---- 5,0
- Natriumtiosulfat---- 5,0
- Ammoniumjärncitrat---- 1,5
- Fuchsin---- 0,1
- Bromtymolblått---- 0,065
- Agar---- 14,0
pH 7,5 + 0,2
Salmonella/Shigella-agar (SS-agar). Komposition och egenskaper hos detta substrat ungefär som DC-agar men utnyttjar egenskaper hos gallsalter, citrat och brilliantgrönt för att hämma normalflora. Salmonella-och flertalet Shigella- (men inte alla) stammar växer i färglösa kolonier. De förra får ofta grått/svart centrum. Laktospositiva bakterier blir rosafärgade. Osäker växt av Shigella och även Yersinia. Substratet torde inte erbjuda några fördelar framför DC-Hynes, och erbjuder därtill osäkrare växt av Shigella.
Brilliantgrön-agar. Avsedd för isolering av Salmonella-bakterier (dock ej S. Typhi), men p.g.a. relativt hög koncentration av brilliantgrönt (0,005-0,03 gram/L) ej för Shigella-bakterier från t.ex. fecesprov.
Bilaga 1.1.4
Anrikningsbuljonger
(Observera att inga bra buljonger finns för anrikning av Shigella)
Rappaport-buljong[redigera]
Rappaport-buljong (modifierad enligt Vassiliadis och van Schothorst) utgör referensbuljong. Avsedd för anrikning av Salmonella-bakterier (utom S. Typhi och ett fåtal andra stammar) från bl.a. human feces. Selektiva egenskaper bygger framför allt på Salmonella-bakteriernas bättre förmåga att överleva hög magnesiumjonkoncentration än koliforma bakterier och deras relativa motståndskraft mot malakitgrönt (0,4 %) i kombination med hög temperatur (41,5 °C + 0,5 °C). Rappaportbuljong förmår ofta anrika en insådd < () Salmonella-bakterier och samtidigt undertrycka > koliforma bakterier.
Recept: (Merck 1.07700.0500) Rapportbuljong
- Innehåll---- Gram/L
- Soyapepton---- 4,5
- Natriumklorid---- 8,0
- KH2PO4---- 0,6
- K2HPO4---- 0,4
- MgCl2.6 H2O---- 29,0
- Malakitgrönt---- 0,036
pH 5,2 + 0,2
Alternativ-buljonger[redigera]
Selenit-buljong (laktosbaserad) är acceptabel som alternativ till referensbuljongen. Avsedd för anrikning av Salmonella-bakterier inkl. S. Typhi, men vissa Shigella (framför allt Shigella sonnei) kan också anrikas. Baseras på selektiva egenskaper hos natriumbiselenit, vilket i olöst tillstånd möjligen har teratogena egenskaper. Lösningen är korrosiv och kan orsaka sår på hud. Det måste därför tillsättas som lösning vilken förvaras i giftskåp. Proteus och Pseudomonas inhiberas inte. Inkuberas i 35 °C - 37 °C (eventuellt 41,5 °C + 0,5 °C vilket kan undertrycka kontaminerande gramnegativ flora effektivare) i upp till 18-22 tim. Vid längre tider kan de selektiva egenskaperna förloras.
Recept: (Laktosbaserad selenit buljong, Oxoid CM395)
- Innehåll---- Gram/L
- Pepton---- 5,0
- Laktos---- 4,0
- Natriumfosfat---- 10,0
pH 7,1 + 0,2
Natriumbiselenit (L121) tillsättes i lösning 4 gram.
Förutom Rappaport- eller selenitbuljong, användes ibland också den mindre väldefinierade Muller-Kauffmann tetrathionate-buljongen för anrikning av Salmonella-bakterier (utom S. Typhi). Denna utnyttjar selektiva egenskaper hos oxgalla och brilliantgrönt och inkuberas i 41,5 °C + 0,5 °C.
Yersinia substrat[redigera]
Bilaga 1.1.5
CIN-agar (Yersinia Selective Agar Base enligt Schiemann)[redigera]
Indikation: För primärisolering av Yersinia enterocolitica (och Y. pseudotuberculosis ) från humana fecesprov.
Princip: Mediet är optimerat för växt av Y. enterocolitica efter 18-24 timmars inkubation i 28 °C - 32 °C. Många stammar av Y. pseudotuberculosis växer inom två dygn. Tillsatsen av Cefsulodin, Irgasan och Novobiocin (CIN) och natriumdesoxycholat är tillräcklig för att hämma flertalet bakterier ur normalfloran. Substratets grundfärg är blekt rosa. Typiskt koloniutseende för Yersinia-bakterier baserar sig på fermentation av mannitol. Det skall dock observeras att CIN-agar inte kan skilja patogena biotyper från apatogena. Dessutom antar vissa andra gramnegativa bakterier som förmår att växa på CIN-agar ofta samma koloniutseende som Yersinia. Dit hör Citrobacter, Serratia, Enterobacter, Pseudomonas (oftast färglösa kolonier) samt Aeromonas. CIN-agar har därmed hög selektiv men låg differentierande kapacitet. För komplett primär Yersinia-diagnostik krävs därför kompletterande biokemi inklusive eskulinhydrolystest.
Växtarakteristika: Typiskt koloniutseende för Y. enterocolitica och Y. pseudotuberculosis är små centralt mörkröda, i periferin färglösa kolonier (bull´s eye). Jämfört med icke inhibitoriskt kontrollsubstrat växer de flesta stammarna med GI >50 %.
Recept: (CIN-agar enligt Shiemann, LabM Lab 120)
- Innehåll---- Gram/L
- Special pepton---- 22,5
- Mannitol---- 20,0
- Natriumklorid---- 1,0
- Magnesiumsulfat---- 0,01
- Natriumpyruvat---- 2,0
- Natriumdesoxycholat---- 0,5
- Neutralrött---- 0,03
- Kristallviolett---- 0,001
- Agar No. 2---- 12,0
pH: 7,4+ 0.2
Två ampuller antibiotika CIN supplement X120 tillsättes. Dessa innehål¬ler:
- Cefsulodin---- 7,5 mg
- Irgasan---- 2,0 mg
- Novobiocin---- 1,25 mg
Bilaga 1.1.6
Yersinia selective agar (enligt Wauters)[redigera]
Förutom ovanstående referenssubstrat för primärisolering av Yersinia-bakterier, saluförs också Yersinia selective agar enligt Wauters. Mediet baseras på inhibition av normalfloran genom desoxycholate, oxgalla och citrat, medan grampositiv flora inhiberas av brilliantgrönt. Trots detta är substratet mindre selektivt än CIN-agar. I likhet med detta är substratet i liten omfattning differentierande.
Recept (Yersinia selective agar enl. Wauters, Merck cat. No 1.11443.0500)
- Innehåll---- Gram/L* Köttextrakt 5,0
- Köttpepton---- 5,0
- Jästextrakt---- 5,0
- Laktos---- 10,0
- Neutralrött---- 0,025
- Oxgalla---- 8,5
- Natriumcitrat---- 10,0
- Natriumtiosulfat---- 8,5
- Järncitrat---- 1,0
- Natriumdesoxycholate---- 10,0
- Kalciumklorid---- 1,0
- Brilliantgrönt---- 0,0003
- Agar---- 12,0
pH 7,4 ±0.2
Det långt mindre selektiva MacConkey-agarmediet understödjer också växt av Yersinia-bakterier och kan vara ett alternativ för primärisolering av Y. pseudotuberculosis.
Peptonbaserade anrikningsbuljonger för Yersinia saluförs med olika tillsatser av selektiva komponenter. Exempel på sådana är Wauters medium och Ossmers medium. Inkuberingen i dessa sker i ett till två dygn i 22 °C - 30 °C. Användandet av sådana buljonger ingår inte i referensmetodiken, och värdet av förfarandet är oklart.
Bilaga 1.1.7
SSI-Enteric medium[redigera]
Indikation: Substratet är avsett för isolering av Salmonella, Shigella, Yersinia och E. coli från humana fecesprov. Substratets plats i den diagnostiska arsenalen är oklar eftersom erfarenhet i landet saknas. En mindre utvärdering vid Västeråslaboratoriet (ej omfattande Yersinia) antyder att substratet i klinisk praxis erbjuder relativt god differentiering av olika kolonityper.
Princip: Substratet är ett komplext medium som utvecklats av Statens Seruminstitut, Danmark. Det utnyttjar en kombination av dodecylbenzolsulfat och desoxycholat för inhibition av grampositiva bakterier och svärmning av Proteus. Obetydlig inhibition av gramnegativa stavar. Goda differentierande egenskaper. Sålunda framträder laktospositiva kolonier rosafärgade, H2S-producerande centralt grå-svarta. Brunt färgomslag uppstår i mediet runt deaminaspositiva kolonier (Proteus). Mediets grundfärg är blekt rosa.
Växtkarakteristika: Salmonella växer inom ett dygn med GI relativt CLED på ca 100 % med stora släta kolonier med svart centrum och uppklarning i mediet. Liksom Hektoen-agar ger det mycket god växt också av S. Senftenberg. Shigella växer inom ett dygn med stora råa, färglösa till rosa/röda kolonier med ett GI liknande det för DC-agar. God växt av Yersinia enterocolitica som framträder med små kolonier eventuellt med rött centrum. Proteus mirabilis, Citrobacter braakii och E. coli (CCUG 17 621 och 30 600) inhiberas obetydligt (GI 60-100 %). Enterococcus hirae växer inte. Det är mycket viktigt med ett omsorgsfullt gjort tertialstryk när fecesprovet applicerats, så att fria kolonier erhålls.
Recept: SSI-Enteric medium (Statens Seruminstitut, Danmark). Tillverkaren anger inte mängden av de enskilda komponenterna.
- Pancreatic digest of casein. Jästextrakt. Tri-Na-citrat, CaCl2, MgCl2, L-trypto¬fan, L-fenylalanin, järncitrat, dodecylbenzolsulfat, glukos, laktos, puryvat, desoxycholat, Na-thiosulfat, neutralrött, glycerofosfat, agar.
Campylobacter substrat[redigera]
Bilaga 1.1.8
Blodfri selektiv campylobacteragar (CCDA)[redigera]
Indikation: Primärisolering av Campylobacter jejuni/coli från humana fecesprov.
Princip: I detta medium har blod ersatts av bakteriologiskt kol, järnsulfat och natriumpyruvat, vilket ger mediet en svart grundfärg. En väl balanserad peptonblandning ger god växt av flertalet typer av Campylobacter även vid 37 °C. Tillsats av selektivt supplement undertrycker normalfloran och vissa Campylobacter-arter, men tillåter växt av C. jejuni/coli och C. lari. Supplementet består av cefoperazone och amfotericin, vilket tillsammans med desoxycholat effektivt inhiberar de flesta bakterier och svampar ur normalfloran. Tillsats av kristallviolett kan ytterligare förstärka inhibition av grampositiva bakterier. För isolering av mer antibiotikakänsliga arter som exempelvis C. upsaliensis och C. fetus måste selektivt supplement utelämnas. Campylobacter växer med typiskt koloniutseende och med ringa genomslag av kontaminerande fecesflora efter 18-24 (48) timmars inkubering i 37 °C - 42 °C i mikroaerofil miljö.
Växtkarakteristika: Campylobacter växer vid rekommenderade 42 °C inom två dygn med GI relativt hästblodagar på 20-90 %. Kolonierna är stora, platta och oregelbundet formade med en diameter på 0,5 – 1 cm. Kolonierna är genomskinliga till semiopaka och kan delvis anta en gråblå färg. ”Metalliskt” inslag är vanligt. Växtsättet är ofta utflytande eller ”svärmande”.
E coli, Proteus mirabilis, Citrobacter braakii, enterokocker och Pseudomonas inhiberas effektivt. Genomslag av ett par till flera kolonier av gramnegativ kontaminerande flora förekommer dock i ca 15 % av odlingar.
Recept: Blodfri selektiv campylobacteragar (CCDA enligt Hutchinson och Bolton, LAB M 112).
- Innehåll---- Gram/L
- Peptonblandning---- 25,0
- Bakteriologiskt kol---- 4,0
- NaCl---- 3,0
- Natriumdesoxycholat---- 1,0
- Järnsulfat---- 0,25
- Natriumpyruvat---- 0,25
- Agar No 2---- 12,0
PH 7,4 ± 0,2
Tillred blodfri selektiv campylobacteragar efter tillsats av kristallviolett 1 mL 0,1 % till 1000 mL och antibiotikasupplement X112 (cefoperazone 32 mg/L och amfotericin 10 mg/L). Supplementet X112 utelämnas vid tillredning av blodfri campylobacteragar utan antibiotika.
Bilaga 1.1.9
Campylobacteragar enligt Skirrow[redigera]
Förutom ovanstående referenssubstrat för primärisolering av Campylobacter är en något mindre selektiv blodbaserad campylobacteragar enligt Skirrow ett accepterat alternativ. Denna understödjer växt av Campylobacter jejuni/coli marginellt bättre än referenssubstratet, men med större genomslag av kontaminerande normalflora. Vid tillredningen rekommenderas blod-agarbas no 2 framför Brucella-agarbas (medger bättre Campylobacterväxt och inhibition av normalfloran). Mediets grundfärg är djupröd. Typiska kolonier av Campylobacter växer inom två dygn med 0,5-1 cm stora oregelbundna, platta krämfärgade eller gråa kolonier som särskilt på nytillverkat substrat tenderar att svärma. GI relativt hästblodagar är 50-100 %.
Recept: Blodbaserad campylobacteragar enligt Skirrow.
- Innehåll---- Gram/L
- Blod-agarbas no 2 (OXOID CM 271) (1)---- 40,0
- Campylob selective suppl (OXOID SR 069E) (2) ---- 2 ampuller/1000 mL medium
- Defibrinerat hästblod---- 50,0-70,0 mL
(1)
- Proteos pepton---- 15,0 g
- Leverextrakt---- 2,5 g
- Jästextrakt---- 5,0 g
- NaCl---- 5,0 g
- Agar---- 12,0 g
H 7,4 ± 0,2
(2)
En ampull (för 500 mL medium) innehåller:
- Vankomycin---- 5,0 mg
- Trimetoprim---- 2,5 mg
- Polymyxin B---- 1250 IU
Clostridium difficile substrat[redigera]
Bilaga 1.1.10
CCFA- Cykloserin- Cefoxitin- Fruktos- Agar[redigera]
Indikation: För primär isolering av Clostridium difficile från humana fecesprov.
Princip: Selektivt substrat som understödjer växt av de flesta stammar av C. difficile. Mediet har utan blodtillsats en ljust orange/aprikos grundfärg. Selektiva komponenter är D-cykloserin 250-500 μg/mL och cefoxitin 8-16 μg/mL. De högre koncentrationerna kan verka inhiberande på vissa C. difficile-stammar. Selektiviteten kan dock minska betydligt vid användandet av de lägre koncentrationerna. Vid denna nivå rekommenderas i litteraturen alkoholbehandling av provet före applikation. (De enskilda laboratorierna bestämmer utifrån detta lämplig koncentration). Med den högre koncentrationen inhiberas många av normalflorans Enterobacteriaceae, E. faecalis, stafylokocker, anaeroba bakterier (inkluderande många andra arter av klostridier). Fruktos som inkorporerats i mediet understödjer växt av C. difficile. Idag rekommenderas tillsats av 7 % defibrinerat hästblod vilket enligt vissa författare signifikant ökar sensitivitet jämfört med ingen tillsats eller tillsats av Egg-yolk. Observera att olika fabrikat och sannolikt olika loter kan uppvisa stora skillnader. Noggrann lotjämförelse rekommenderas vid upphandling.
Växtkarakteristika:
Medium med blod (referensberedning): Clostridium difficile växer inom två dygn med platta, gråa kolonier ofta med utseende ”stekt ägg” utan hemolys. Kolonierna kan också vara utflytande och konfluerande. Storlek varierar uppåt från ca 4 mm diameter. Typisk ”stallukt”. Vid genomslag av koliforma kontaminanter (ofta kraftigare än med plattor utan blod) ses dessa som mindre (ett par mm diameter) gråvita blanka kolonier.
Medium utan blod: Clostridium difficile växer inom två dygn med platta, gula, runda eller oregelbundet formade kolonier, med gult omslag i mediet. RGI jämfört med CCFA med blod 10-50 % (jämförelse gjord på Västeråslaboratoriet). Storlek varierar mellan 2-5 mm diameter. Typisk ”stallukt”. Särskilt vid inkuberingstider överstigande tre dygn ofta genomslag av kontaminerande normalflora även vid höga koncentrationer av inhibitorer. Kolonierna är dock ofta små och rosa och lätta att skilja från C. difficile.
Recept: CCFA (Referensfabrikat anges ej)
- Innehåll---- Gram/L
- Proteos pepton---- 40,0
- Fruktos---- 6,0
- DiNatriumfosfat---- 5,0
- Kaliumfosfat---- 1,0
- Magnesiumsulfat---- 0,1
- NaCl---- 2,0
- Neutralrött (ej om blodtillsats)--- 0,03
- Agar---- 15,0
pH 7,4 ± 0,2
Bered CCFA enligt tillverkarens anvisningar med tillsats av 7 % defibrinerat hästblod (och/eller Egg Yolk emulsion 2,5 ml/L), cykloserin (0,25-0,5 g/L) och cefoxitin (0,008-0,016 g/L).
EHEC[redigera]
Bilaga 1.1.11
Sorbitol MacConkey-agar (SMAC)[redigera]
Indikation: För primär isolering av E. coli O157:H7 från humana fecesprov.
Princip: SMAC är i princip identisk med MacConkey-agar no 3 (se detta substrat) men där laktos ersatts med samma mängd sorbitol. Därvid blir sorbitolpositiva bakterier rosa/röda medan negativa förblir ofärgade. Då de flesta stammar av E. coli är såväl laktos som sorbitolpositiva är ett antal stammar enbart laktospositiva. Sådana sorbitolnegativa stammar återfinns bland rörliga isolat av serotyp O157 (E. coli O157:H7). Orörliga stammar (E. coli O157:H-) är laktospositiva.
Selektiv SMAC, CT-SMAC: För isolering av EHEC O 157 används ibland SMAC med tillsats av cefixime 0,05 mg/L och kaliumtellurit 2,5 mg/L.
Växtkarakteristika: Kolonimorfologi och växtsätt är i princip som för MacConkey-agar no 3. E. coli O157:H7 växer med färglösa men för övrigt typiska E. coli-kolonier. Det bör observeras att laktosnegativa bakteriearter kan vara sorbitolpositiva (rosa/röda) på SMAC. Dit hör många stammar av Salmonella, Shigella (40 %) och Yersinia. Typiskt sorbitol-negativa gramnegativa bakteriearter är Hafnia, Morganella och Proteus.
Recept: SMAC (Oxoid CM813)
- Innehåll---- Gram/L
- Pepton---- 20,0
- Sorbitol---- 10,0
- Gallsalter no 3---- 1,5
- NaCl---- 5,0
- Neutralrött---- 0,03
- Kristallviolett---- 0,001
- Agar---- 15,0
pH 7,1 ±-0,2
Bilaga 1.1.12
Buffrat peptonvatten (BPV)[redigera]
Indikation: För anrikning av EHEC
Princip: Enterobakterier växer snabbare än många andra bakterier
Recept
- Innehåll---- Gram/L
- Pepton Difco---- 10 g
- NaCl---- 5 g
- Dinatriumvätefosfat x12 H2O---- 9 g
- Kaliumdivätefosfat---- 1,5 g
- Ultrarent vatten---- 1000 ml
pH 7,2 ± 0,2 vid 25 °C
Vibrio[redigera]
Bilaga 1.1.13
Tiosulfat- citrat- galla- sackaros- agar (TCBS)[redigera]
Indikation: För selektiv isolering av Vibrio från humana fecesprov och sekundärisolering efter anrikning i alkaliskt peptonvatten.
Princip: TCBS utvecklades av Kobayaski et al. 1963 för isolering av Vibrio cholerae. Substratet undertrycker växt av praktiskt taget alla bakteriearter i normal tarmflora under 24 timmar, medan de allra flesta stammar av humanpatogena Vibrio (ej V. hollisae) växer ut. Viss växt av Proteus och enterokocker kan dock förekomma under första dygnet, liksom av Aeromonas. Mediets selektiva egenskaper åstadkoms av alkaliskt pH (8,6), natrium-citrat, natrium-tiosulfat, oxgalla och hög salthalt (NaCl 10,0 g/L). Sackarospositiva bakterier blir gul/bruna med gult färgomslag i mediet. Sackarosnegativa bakterier framträder blå till gröna. Trots identiska recept har vid substrattestning (West et al 1982) stora variationer påvisats mellan olika fabrikat och även avseende reproducerbarhet vid användandet av olika laboratoriestammar. Aktuell utvärdering saknas, varför referensfabrikat av TCBS ej kan anges.
Växtkarakteristika: Vibrio cholerae och V. fluvialis växer inom 24 timmar vid 35 °C med platta jämna gul/bruna kolonier med en diameter av 2-3 mm. V. parahaemolyticus växer med blå-gröna 2-5 mm stora platta kolonier. Eventuellt genomslag av fecesflora uppträder med mindre (1 mm diameter) gula eller blå/gröna kolonier.
Recept: TCBS-agar (Referensfabrikat anges ej)
- Innehåll---- Gram/L
- Jästextrakt 5,0
- Pepton 10,0
- Natriumtiosulfat 10,0
- Natriumcitrat 10,0
- Oxgalla 8,0
- Sackaros (Sukros) 20,0
- NaCl 10,0
- Järncitrat 1,0
- Bromtymolblått 0,04
- Thymolblått 0,04
- Agar 15,0
pH 8,6 ± 0,2
Bilaga 1.1.14
Alkaliskt peptonvatten[redigera]
Indikation: Anrikning av kolerabakterier.
Princip: Vibrio cholerae växer snabbare än alla andra bakterier, speciellt vid basiskt pH.
Recept
- Innehåll---- Gram/L
- Pepton Acumedia---- 10 g
- NaCl---- 5 g
- RO-vatten---- 1000 mL
- NaOH---- ca mL
ca mL pH 9,1± 0.1
Beredning: Väg upp pepton och salt och blanda i vattnet i en flaska eller kolv. Justera pH med NaOH. Dispensera i glasrör med skruvlock ca 10 mL per rör. Autoklavera i 20 min i 120 °C.
Internkontroll:
Satskontroll vid varje tillverkningsomgång.
V. cholerae ATCC 14035 god växt
E. coli CCUG 17620 ingen växt eller hämmad
Inkubering aerobt i 35 °C 1 dygn
Förvaring och hållbarhet: 6 veckor i kyl. Om hållbarhetsdatum passerats kan rören användas efter kontroll av pH samt om kontrollstam sätts samtidigt som prov odlas.
Övriga fasta substrat[redigera]
Bilaga 1.1.15
MacConkey-agar[redigera]
Indikation: Rensspridning av misstänkta Salmonella-, Shigella- och Yersinia-bakterier i samband med initial identifiering enligt minimikriterier och som komplement vid primär isolering från humanfeces av Y. pseudotuberculosis.
Princip: Olika typer av MacConkey-agar finns kommersiellt tillgängliga. Referenssubstrat i detta sammanhang är komponerat för inhibition av grampositiva kocker inklusive enterokocker, men endast för ringa eller ingen inhibition av koliforma bakterier (Proteus svärmar ej). Detta uppnås med användande av en kombination av olika gallsalter och kristallviolett. Mediet innehåller laktos och neutralrött. Detta medför att laktospositiva bakterier blir rosa-röda, medan laktosnegativa bakterier förblir färglösa.
Växtkarakteristika: Salmonella-bakterier växer inom ett dygn med GI överstigande 80 % jämfört med icke selektivt substrat i de allra flesta fall (undantag t.ex. S. Senftenberg CCUG 37886). Kolonierna är därvid konvexa, semiopaka, blanka, ibland råa och färglösa. Kolonidiametern motsvarar den för DC-Hynes. Shigella-bakterier växer inom ett dygn med GI överstigande 50 % med konvexa, semiopaka, råa och färglösa kolonier. Yersinia (såväl Y. enterocolitica som Y. pseudotuberculosis) växer inom ett dygn med små eller mycket små kolonier och ett GI jämfört med CLED-agar på ca 25-50 %. Kolonierna är konvexa, semiopaka, släta och färglösa.
E. coli och andra laktospositiva koliforma bakterier växer med GI överstigande 50 % med rosa/röda kolonier. Proteus-bakterier svärmar ej. Enterokocker växer ej. Substratets egenskaper gör det lämpligt att använda vid renspridning av misstänkta Salmonella-, Shigella- och Yersinia-bakterier i samband med identifiering enligt minimikriterier. Mer selektiva substrat är i sammanhanget olämpliga, eftersom dessa kan undertrycka eventuella förorenande koliforma bakterier.
Recept: (MacConkey-agar no. 3, Oxoid CM 115)
- Innehåll--- Gram/L
- Pepton---- 20,0
- Laktos---- 10,0
- Gallsalter no.---- 3 1,5
- NaCl---- 5,0
- Neutralrött---- 0,03
- Kristallviolett---- 0,001
- Agar---- 15,0
pH: 7,1+0,2
Bilaga 1.1.16
Egg-Yolk-agar[redigera]
Indikation: Påvisande av lecitinasproduktion vid diagnostik av i första hand Bacillus cereus, Clostridium perfringens och andra klostridiearter associerade till klinisk gasbrand och matförgiftning. Differentiering av fusobakterier genom påvisande av lipas-aktivitet. Prevotella spp kan uppvisa både lecitinas-och lipasaktivitet.
Princip: Äggula (Egg yolk) innehåller lecitin och fria fetter, substrat som är lämpade för påvisande av mikrobiell produktion av lecitinas och lipaser. McClug, Toube och Hayward beskrev 1941 att Clostridium perfringens som växer på fast medium innehållande ägguleemulsion orsakar ett kraftigt mjölkigt precipitat i mediet inom 24 timmar. Precipitatet uppstår genom att bakteriellt lecitinas (fosfolipas C, alfa-toxin som vid mjukdelsinfektioner spelar stor roll till uppkomst av klinisk gasbrand) spjälkar lecitin (fosfatidylkolin, vitellin) i sina beståndsdelar fosforylkolin och diglycerider. De senare reagerar med i äggulan kvarvarande vitellin och vitellinin under precipitatbildning. Lecitinaser med samma effekt produceras också av andra klostridiearter som C. novyi, C. bifermentans, C. limosum och C. sordelli. Andra bakterietyper som B. cereus, B. anthracis, S. aureus och vissa stammar av B. cepacia producerar också påvisbart lecitinas. För att säkerställa att uppkommet precipitat härrör från bakteriellt lecitinas användes tidigare neutraliserande artspecifikt antitoxin som applicerades på halva agarytan med effekten att bakterierna växte där utan bildning av precipitat (Naglers reaktion). Numera appliceras ofta istället positiv och negativ bakteriekontroll på testplattan.
Mikroorganismer med lipas-aktivitet hydrolyserar fetter i mediet till glycerol och fria fettsyror. Olösliga fria fettsyror bildar inom två till fem dygns inkubering ett regnbågsskimrande oljigt lager ovanpå kolonierna som kan ses om plattan hålls i vinkel mot en ljuskälla. Metoden är användbar för att differentiera mellan fusobakterier, Fusobacterium necrophorum är därvid positiv, övriga fusobakterier negativa. Lipasproduktion förekommer också hos andra bakteriearter, exempelvis C. sporogenes
Vissa bakterier orsakar en begränsad uppklarning av mediet i omedelbar anslutning till kolonierna orsakat av proteas-aktivitet.
Växtkarakteristika: Inom ett dygn växer C. perfringens och B. cereus (aerob inkubering varvid B. subtilis utgör lämplig negativ kontroll) anlagda i raka stryk med frodigt grå-vitt, rått, matt utseende. I mediet syns ett kraftigt från ca 1,5 cm brett homogent opakt relativt välavgränsat precipitat talande för lecitinasproduktion. Observera att B. cereus till skillnad från B. subtilis även kan inkuberas anaerobt. Fusobakterier växer inom ett eller några dygn med färglösa platta kolonier, varvid Fusobacterium necrophorum med ett regnbågsskimrande oljigt lager på ytan synligt om plattan hålls i vinkel mot ljuskällan som tecken på lipasaktivitet.
Recept: (Egg-yolk-agar)
Olika agarbaser (ofta specialkomponerade) har genom åren använts tillsammans med egg-yolk-emulsion för att påvisa lectinasbildning hos framförallt B. cereus och klostridier associerade till gasbrand. I dag är det vanligt att vid diagnostik av renspridda isolat för denna reaktion använda kommersiell blodagarbas (till exempel Columbia-agar) kompletterad med 1% koksalt och egg-yolk-emulsion (recept nedan). Substratets grundfärg är därvid blekt gulvit, semiopakt.
- Innehåll---- Gram/L
- Columbia blod agar bas (1) 43
- NaCl 10
- Egg-Yolk-emulsion (Oxoid SR47) 100 mL
(1)
(Acumedia no 7125)
- Innehåll---- Gram/L
- Pankreasdigererat kasein---- 5,0
- Köttextrakt---- 8,0
- Jästanrikad pepton---- 10,0
- Majsstärkelse---- 1,0
- NaCl---- 5,0
- Agar---- 14,0
pH 7,6 ± 0,1 (slut-pH)
Bered Egg-yolk agar efter tillsats av egg-yolk emulsion till avsvalnad (50 °C) blod-agarbas med extra NaCl.
Transportsubstrat[redigera]
Bilaga 1.1.17
Olika typer av transportsubstrat avsedda för alla typer av kliniskt bakteriologiska prover finns idag tillgängliga. Dessa baseras huvudsakligen på Stuarts medium från 1940-talet, vilket senare modifierats för bättre överlevnad bland annat av gonokocker, men också för att bättre bibehålla balansen mellan olika bakteriearter när provet innehåller blandflora. I dag används oftast Amies kolade transportmedium. Kolillsatsen (Charcoal) neutraliserar toxiska fettsyror, varvid man slipper använda kolade bomullspinnar vid provtagningen. Stuarts medium innehåller glycerofosfat, vilket kan metaboliseras av vissa koliforma bakterier med risk för tillväxt under transporten. Därför har i Amies medium detta bytts ut mot oorganiskt fosfat. Amies transportmedium är inte optimerat för transport av fecesprover innehållande Shigella och Campylobacter, men dessa överlever minst 24 timmar i mediet vid kylförvaring. Ett speciellt transportmedium för fecesprover är Cary-Blair-medium. Detta är buffrat till pH 8,4, vilket förlänger överlevnad av Shigella och Vibrio cholerae till åtskilliga dygn. Cary-Blair-medium är inte avsett för transport av andra typer av bakteriologiska prover.
Trots att Cary-Blair-medium har bättre egenskaper vid längre tids förvaring (>48 timmar) anger vi det mer generella och mycket använda Amies medium som referenssubstrat. Det är dock viktigt att vara uppmärksam på nödvändigheten av korta transporttider för Shigella (särskilt Shigella flexneri), Campylobacter och Vibrio.
Recept: Amies transportmedium med charcoal (Copan, Venturi Transystem).
- Innehåll Gram/L
- Charcoal 10,0
- NaCl 3,0
- Natriumvätefosfat 1,15
- Kaliumdivätefosfat 0,2
- KCl 0,2
- Natriumtioglykollat 1,0
- CaCl2 0,1
- MgCl2 0,1
- Agar 4,0
PH 7,2 ± 0,2
Transportrör finns kommersiellt tillgängliga. I certifierad batchprövning ingår bland annat Shigella och Campylobacter med angiven överlevnad minst 24 timmar.