Entamoeba histolytica
Huvudartikel, publicerad april 2011.
Till innehållsförteckngen för Referensmetodik:Parasitologisk diagnostik
Se även Tarminfektioner
och Referensmetodik:Smittskyddslagens sjukdomar med falldefinition i artikeln Entamoeba histolytica, infektion
Entamoeba histolytica[redigera]
Smittämne[redigera]
Den parasit, som då den beskrevs för mera än hundra år sedan fick namnet Entamoeba histolytica, är i själva verket två olika parasiter. Sedan lång tid tillbaka har det varit känt att många människor infekterade med E. histolytica inte utvecklar symtom. Under många år tolkades detta som indikation på en parasit med variabel virulens. Redan 1925 föreslog dock en fransk parasitolog, Emile Brumpt, att det rörde sig om två olika arter, en som kan orsaka invasiv sjukdom och en annan som inte orsakar sjukdom, vilken han kallade Entamoeba dispar. Denna hypotes föll dock i glömska och inte förrän 1993 publicerades en formell omskrivning av den patogena, invasiva E. histolytica som helt åtskiljde den från den apatogena, icke invasiva E. dispar (Diamond et al 1993). Studier från olika delar av världen har visat att ca 90 % av de amöbor som på grund av morfologisk bedömning kallats E. histolytica egentligen har varit E. dispar .
Livscykel[redigera]
Infektion av E. histolytica sker genom intag av parasitens cyststadium via förorenad föda eller vatten. Cystor som passerat magsäcken excysterar i tunntarmen. Trofozoiterna etablerar sig i kolon där de förökar sig genom binär delning. Beroende på olika faktorer såväl hos parasiten som hos värden kan trofozoiterna invadera vävnaden i tjocktarm. Trofozoiterna orsakar en förtunning av slemhinnelagret följt av en förkortning av mikrovilli redan innan de fäster vid vävnaden. Lys av värdcellerna sker vid direktkontakt med trofozoiterna. Dessa bryter igenom lamina propria och det uppstår sår, ofta något upphöjda med en liten öppning i slemhinnans yta med en större flaskformad destruktion under ytan. I lesionerna syns trofozoiterna i gränsskiktet mellan frisk och död vävnad, då de livnär sig på levande celler. Vid diarré hinner inte trofozoiterna encystera vilket däremot sker vid långsammare tarmpassage. Cystorna utsöndras med feces och fullbordar därmed livscykeln. Cystor kan överleva i omgivningen i flera veckor beroende på temperatur och fuktighet. Trofozoiterna är kortlivade utanför kroppen och överlever inte heller passage genom övre magtarmkanalen.
Symtom och klinisk bild[redigera]
Det finns flera kliniska former av invasiv intestinal amoebiasis: dysenteri eller blodig diarré, fulminant kolit, amöba-appendicit och amöbom i kolon. Dysenteri och diarrésyndrom står för övervägande delen av fallen. Patienter med dysenteri eller blodig diarré har dagligen cirka tre till fem avföringar med blodfärgat slem eller tunnare blodig diarré. Feber och andra systematiska manifestationer förekommer vanligtvis inte i motsats till dysenteri orsakad av bakterier (Espinosa-Cantello et al 2000). Svår, långvarig dysenteri med mera än tio avföringar per dag kan leda till viktminskning och svår utmattning. Akuta fall kan påminna om appendicit eller kolecystit. Den allvarligaste komplikationen vid invasiv intestinal amoebiasis är perforation av tarmen med sekundär bakteriell peritonit.
Även asymtomatisk intestinal infektion med verifierad förekomst av E. histolytica förekommer. En liten andel av infekterade patienter utvecklar extraintestinal invasiv amoebiasis. Genom spridning med blodet kan trofozoiter ge upphov till extraintestinala lesioner, främst i levern. Spridning till levern sker via portacirkulationen. Leverabscess är vanligare hos män än kvinnor (ratio 1:7) och en typisk patient är en man i 20-40 års-åldern med feber och smärtor i övre högra leverkvadranten sedan en till två veckor. Hematogen spridning kan också ske till andra organ, bland annat lungor och hjärna.
Epidemiologi[redigera]
Människa är den enda reservoaren för E. histolytica. Cystor av E. histolytica sprids via vatten eller föda. Cystor av E. histolytica överlever klorering men avlägsnas vanligtvis från dricksvattnet med sandfiltrering. E. histolytica förekommer i hela världen, men är endast endemisk i områden med dålig omgivningshygien. Enligt en WHO-rapport från 1998 orsakar amoebiasis ca 70 000 dödsfall om året. Årligen anmäls ca 200-300 fall av Entamoeba histolytica till SMI (SmiNet) men då många av dessa anmälningar grundar sig på mikroskopi är ett stort antal av de anmälda fallen antagligen E. dispar. Species-differentiering med PCR, som utförts på Folkhälsomyndigheten (SMI) sedan 2001, har visat att mindre än 10 % av fall med E. histolytica/E. dispar-positiv mikroskopi är infekterade med E. histolytica.
Provtagning och transport[redigera]
Provmaterial[redigera]
För morfologi och PCR:
- feces, abscessmaterial
Observera att material för PCR skall inte formalin- eller SAF-fixeras. Mycket tunn feces och abscessmaterial bör etanolfixeras.
För serologi:
- Serum (blodrör utan tillsats), plasma (EDTA-blodrör).
Provtagning[redigera]
Laboratoriediagnostik[redigera]
Allmänt[redigera]
Diagnostik av intestinal amoebiasis har fram till nu främst grundat sig på mikroskopisk påvisning av parasiten i feces. Cystor påvisas vanligen efter formalin/etylacetat-koncentrering och trofozoiter påvisas i färskprov. Då utsöndring av parasiter sker intermittent rekommenderas upprepad provtagning vid negativt fynd. Någon morfologisk referensmetodik för specifik identifiering av E. histolytica cystor finns för närvarande inte, då cystformerna av E. histolytica och E. dispar är morfologiskt identiska. En tredje amöba med identisk cystmorfologi, Entamoeba moshkovskii, har också rönt uppmärksamhet på senare tid. E. moshkovskii betraktades tidigare som en frilevande amöba, som endast i undantagsfall kunde infektera människa, men har nu rapporterats i humanprov från olika håll av världen. Differentiering av olika Entamoeba species kan ske med PCR-metodik.
Endast förekomst av trofozoiter innehållande fagocyterade erytrocyter kan bedömas som E.histolytica, alla andra fynd är att betrakta som E. histolytica/E. dispar.
Referensmetodik för morfologisk screening av Entamoeba histolytica/E. dispar i feces[redigera]
Påvisning av cystor[redigera]
Cystor av E.histolytica/dispar påvisas i ofärgat eller jodfärgat preparat efter formalin/etylacetatkoncentrering (bilaga PAR 01). Observera att denna metod inte är lämplig för trofozoitpåvisning.
Påvisning av trofozoiter[redigera]
För påvisning av trofozoiter i feces i färskprov, alternativt i slemhinneskrap taget vid rektoskopi, fordras ett nytaget prov. Denna metodik kräver att patienten befinner sig i närheten av laboratoriet, då provet måste undersökas så snabbt som möjligt efter provtagningen. Fecesprov granskas med avseende på slemmiga eller blodiga partier eftersom det är troligast att dessa delar innehåller trofozoiter. Provet slammas upp i liten mängd förvärmd 0,9 % natriumklorid och undersöks mikroskopiskt med avseende på rörliga trofozoiter. Vid fynd av amöbatrofozoiter skall det alltid anges om intracellulära erytrocyter föreligger och endast dessa fynd skall svaras ut som E. histolytica. Övriga trofozoiter som fyller de morfologiska kriterierna nedan utsvaras trofozoiter av E. histolytica/E. dispar.
Mikroskopisk undersökning av abscessmaterial från lever eller andra organ kan utföras på liknande sätt, men känsligheten är låg.
Trikromfärgning[redigera]
Om färskprov inte kan undersökas inom rimlig tidsrymd (ca 1-2 timmar) eller på grund av infektionsrisk kan provmaterial fixeras i SAF-fixativ i direkt anslutning till provtagningen och trikromfärgning utföras senare, eventuellt skickas till annat laboratorium. Trikromfärgning (PAR 03) ger ett permanent preparat och metoden finns för närvarande vid ett antal parasitologiska laboratorier i Sverige.
Morfologiska kriterier[redigera]
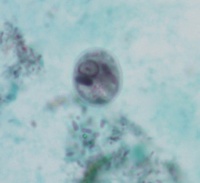
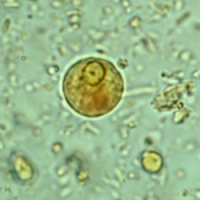
- Cystor av E. histolytica/dispar: Fullt utvecklade cystor är sfäriska och innehåller fyra kärnor. Storleken kan variera från 10-16 µm. Omogna cystor innehåller en eller två kärnor. Kärnorna har en liten kompakt centralt belägen karyosom och fint granulerat perifert kromatin. Unga cystor innehåller ibland en koncentrerad glykogen-massa som tar upp jodfärg. Avlånga kromatinkroppar med rundade ändar kan förekomma.
- Trofozoiter av E. histolytica/dispar: Storleken kan variera mellan 20-40 µm. Levande trofozoiter uppvisar progressiv rörlighet; ektoplasman i form av hyalina fingerlika pseudopoder skjuts ut och endoplasman “rinner över” i pseudopoden varvid organismen förflyttar sig. I ofärgat upplägg syns inte kärnan, medan trikromfärgade preparat i klassiska fall visar en kärna med en liten kompakt centralt belägen karyosom och med fint granulerat perifert kromatin. Endast E. histolytica kan ta upp erytrocyter. Påvisning av erytrocyter i trofozoiternas cytoplasma är en förutsättning för morfologisk klassifiering av trofozoiter som E. histolytica.
Diagnostiska problem vid morfologisk diagnostik[redigera]
Vid bacillär dysenteri kan feces innehålla stora makrofager som påminner om amöbatrofozoiter, då de kan innehålla erytrocyter och ha pseudopoder. De rör sig dock inte "progressivt" som E. histolytica. Unga cystor av E. histolytica/E. dispar med glykogenmassa kan förväxlas med Iodamoeba -cystor; emellertid kan cystorna lätt skiljas åt genom att kärnstrukturen observeras. Cystor av E. hartmanni är morfologiskt identiska med E. histolytica/dispar men skiljs från dessa genom sin mindre storlek. Unga cystor av Entamoeba coli har en till fyra kärnor liksom E. histolytica/E. dispar, och det krävs noggrann observation av kärnstruktur och eventuella kromatinstavar för att förväxling inte skall ske.
Identifiering till speciesnivå/epidemiologisk typning[redigera]
För identifiering av species (E. histolytica eller E. dispar) rekommenderas PCR. Denna teknik utförs vid Folkhälsomyndigheten och håller för närvarande på att etableras vid några andra laboratorier. Metoden fungerar inte lika tillfredställande på formalinbehandlade prov varför ytterligare provtagning rekommenderas om den initiala diagnosen ställts på SAF eller formalinfixerat material.
Kvalitetskontroll[redigera]
Entamoeba histolytica/E. dispar cystor ingår i UK-NEQAS feces-utskick.
Svarsrutiner[redigera]
Trofozoiter alternativt cystor av E. histolytica/E. dispar påvisade/ej påvisade
OBS Enbart trofozoiter som innehåller intracellulära erytrocyter kan utsvaras: trofozoiter av Entamoeba histolytica (med intracellulära erytrocyter) påvisade.
Övriga diagnostiska metoder[redigera]
Antigendetektion[redigera]
TechLab E. histolytica II test och Entamoeba CELISA PATH är framtagna för att specifikt kunna påvisa E. histolytica i fecesprover. Testerna bygger på detektion av specifikt E. histolytica-adhesin med ELISA-teknik. Testerna är specifika men känsligheten är låg (reagerar endast med trofozoiter) vilket begränsar värdet i ett icke-endemiskt område. För optimalt utbyte skall dessutom analyserna utföras på färska fecesprover (inom 24 timmar) vilket ytterligare begränsar användbarheten.
Immuncytologiska metoder[redigera]
Inga antikroppar specifika mot E. histolytica trofozoiter eller cystor lämpade för immuncytologi finns kommersiellt tillgängliga.
Nukleinsyrapåvisning med PCR[redigera]
Ett flertal PCR-metoder för E. histolytica och E. dispar, både för konventionell PCR och realtids-PCR, finns beskrivna. Metoderna kan användas för primärdiagnostik, speciellt vid undersökning av abscess-material, där mikroskopi har mycket låg känslighet, och för speciesidentifiering vid redan påvisad E. histolytica/E. dispar-infektion.
Serologi[redigera]
Serologi rekommenderas främst för diagnostik av extra-intestinal amoebiasis då det är osannolikt att den sjukdomsorsakande parasiten fortfarande finns kvar i feces. Flera serologiska metoder finns att tillgå, både ”in house”-metoder och kommersiella kits. Här inkluderas klassiska metoder som precipationstester (t.ex. CAP) och agglutinationsmetoder (latex, indirekt hemagglutination) samt indirekt immunfluorescens (IFL) och ELISA. Metoderna uppvisar varierande känsligheter, mellan 80-99 %. Den högsta känsligheten och specificiteten (>97 %) nås med ELISA-baserade metoder hos patienter från icke-endemiska områden med väl etablerade amöba-abscesser (Fotedar et el, 2007). I tidigt stadium av invasiv amoebiasis kan serologin vara negativ och upprepad provtagning efter några veckor rekommenderas i dessa fall. Kvarstående förhöjda titrar av serumantikroppar mot E. histolytica kan ses hos individer från endemiska områden (från upprepade tidigare infektioner) och göra serologi-svaren svårtolkade.
Serologisk diagnostik av intestinal amoebiasis har begränsad användning och bör kombineras med mikroskopi/PCR. Antikroppstitrarna kan vara låga och därmed svåra att tolka. Vid intestinal invasiv amoebiasis är känsligheten av serologiska tester något lägre än vid extra-intestinala infektioner. Positiva antikroppstitrar kan dock påvisas även hos de flesta asymptomatiska bärare av E. histolytica (Visser et al, 2006). Fynd av parasiter i feces i kombination med positiv serologi kan tala för intestinal amöba-infektion.
Laboratorierapportering[redigera]
Entamoeba histolytica är klassad som en sjukdom utöver allmänfarliga sjukdomar enligt Smittskyddslagen 2004-168 och är både anmälningspliktig och smittspårningspliktig.
Observera att enbart verifierade fall av E. histolytica skall anmälas.
Litteraturhänvisningar[redigera]
- Ali IK, Clark CG, Petri WA Jr. Molecular epidemiology of amoebiasis. InfectGenet Evol. 2008 Sep;8(5):698-707.
- Diamond LS, Clark CG. A redescription of Entamoeba histolytica, 1903 (Emended Walker, 1911) separating it from Entamoeba dispar Brumpt, 1925. J Euk Microbiol 1993;40:340-344.
- Espinoza-Cantello M, Martinez-Palomo. Pathogenesis of intestinal amoebiasis: from molecules to disease. Clin Microbiol Rev 2000;13:318-331.
- Fotedar R, Stark D, Beebe N, Marriott D, Ellis J, Harkness J. Laboratory diagnostic techniques for Entamoeba species. Clin Microbiol Rev. 2007 Jul;20(3):511-32.
- Haque R, Ali IKM, Akther S, Petri Jr WA. Comparison of PCR, isoenzyme analyses, and antigendetection for diagnosis of Entamoeba histolytica infection. J Clin Microbiol 1998;36:449-52.
- Lebbad M, Svärd SG. PCR differentiation of Entamoeba histolytica and Entamoeba dispar from patients with amoeba infection initially diagnosed by microscopy. Scand J Infect Dis. 2005;37(9):680-5.
- Visser LG, Verweij JJ, Van Esbroeck M, Edeling WM, Clerinx J, Polderman AM. Diagnostic methods for differentiation of Entamoeba histolytica and Entamoeba dispar in carriers: Performance and clinical implications in a non-endemic area. Internat J Clin Microbiol 2006, 296: 397-403. WHO. Amoebiasis. Weekly Epidemiol Rec. 1997;72:97-100.