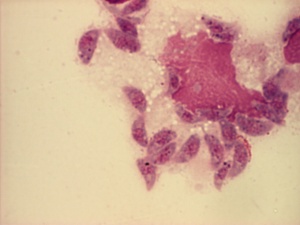
Toxoplasma gondii
Huvudartikel, publicerad april 2012.
Till innehållsförteckning för Referensmetodik:Parasitologisk diagnostik och Referensmetodik: Infektioner i centrala nervsystemet
Toxoplasma gondii[redigera]
Smittämne[redigera]
Toxoplasma gondii är en encellig parasiterande protozoo (urdjur). Släktet Toxoplasma hör till stammen apicomplexa och underklassen coccidia. Toxoplasma gondii är den enda kända arten inom detta släkte. Kattdjur är huvudvärdar och parasiten kan infektera de flesta varmblodiga djur, inklusive människor.
Livscykel[redigera]
Kattdjur spelar en viktig roll för smittspridningen. Parasiten genomgår en sexuell förökningsfas i kattens tarm och infekterade katter kan periodiskt utsöndra infektiösa parasitstadier (oocystor) i avföringen. I miljön kan oocystor vara infektiösa under lång tid (månader till år). Grönsaker, bär, frukt och vatten, som haft kontakt med sådan jord, kan vara smittförande. Djur, som kommer i kontakt med oocystorna, kan bli infekterade och vävnadscystor bildas i deras muskulatur. Får, gris och vilt är vanliga bärare av parasiten (vävnadscystor) och nötkreatur är det i något mindre utsträckning. När kattdjur äter kött från ett infekterat djur, till exempel en gnagare eller en fågel, fullbordas livscykeln.
Människan smittas via intag av kött (innehållande vävnadscystor) eller annan kontaminerad föda (innehållande oocystor). En gravid kvinna kan smitta fostret via moderkakan. Sjukdomen smittar inte från människa till människa. Hos människa förekommer parasiten i två stadier som är av klinisk relevans. Vid primärinfektion utvecklas snabbt replikerande stadier (tachyzoiter) som vandrar ut i cirkulationen och sprids till olika organ, som till exempel hjärna och muskulatur. Där utvecklas vävnadscystor, innehållande bradyzoitstadiet, som kvarstannar under många år eller hela livet. Vid reaktivering av sjukdomen återuppträder tachyzoitstadiet.
Symtom och klinisk bild[redigera]
Toxoplasmos är vanligtvis en självbegränsande sjukdom. Efter genomgången primärinfektion övergår infektionen i latent asymtomatisk form. Primärinfektion kan ge övergående influensaliknande symtom med lymfkörtelförstoring eller vara asymtomatisk. Primärinfektion kan dock ge allvarliga och till och med dödliga följder för människor med immunbrist och för foster om modern smittas för första gången under graviditeten. Den vanligaste kliniska manifestationen av Toxoplasma-infektion i västvärlden är ögoninfektion, oftast i form av recidiverande retinokoroidit hos för övrigt friska individer. Infektion av fostret kan leda till missfall, ögonskador och neurologiska manifestationer (intellekt, motoriska och sensoriska funktioner) hos barnet, ibland postnatalt. Opportunistisk infektion hos immunnedsatta individer kan drabba många organsystem med livshotande encefalit som främsta manifestation.
Epidemiologi[redigera]
Toxoplasma-parasiten finns i alla världsdelar men infektion är sannolikt vanligare i varmt klimat jämfört med kallt. Generellt har seroprevalensen av Toxoplasma minskat under en längre period i den svenska befolkningen: nivåerna i Stockholm låg på slutet av 50-talet närmare 50 %, kring 30 % på 70-talet och runt 20 % i slutet av 80-talet. Nyare studier av gravida kvinnor har visat seroprevalenser på 14-25 %. Denna trend överensstämmer med trenden i Europa och USA. Incidensen av primärinfektion hos gravida i svenska studier har beräknats till 1/2000 och prevalens av kongenital toxoplasmos till mindre än 1/10000 födslar.
Provtagning och transport[redigera]
Provmaterial[redigera]
- Serum/plasma, cerebrospinalvätska (antikroppspåvisning)
- EDTA blod, cerebrospinalvätska, amnionvätska, glaskropp, bronkoalveolär sköljvätska (BAL) samt biopsimaterial (DNA-påvisning)
Nytaget, ofixerat provmaterial fordras för PCR.
Provtagning[redigera]
Laboratoriediagnostik[redigera]
Allmänt[redigera]
Diagnostiken baseras på en kombination av indirekt påvisning av parasiten genom olika specifika serologiska analyser och/eller direkt påvisning av parasitförekomst via PCR. Den kliniska frågeställningen är central för val av metodik, provmaterial och vid tolkning av analysresultat. Det finns några specifika tillstånd där Toxoplasma-infektion ofta förekommer som diagnostisk frågeställning:
- Symtomatisk infektion hos immunkompetent person, inklusive ögoninflammation (retinokoroidit)
- Symtomatisk infektion hos immunsupprimerad person
- Misstanke om primärinfektion hos gravid kvinna
- Misstanke om kongenital infektion hos foster/nyfött barn från mor med primär infektion
I regel utförs indirekt påvisning av parasiten i serumprov (antikroppsbestämning) för att diagnostisera infektion hos personer med intakt immunsystem, medan direkt påvisning med PCR rekommenderas för immunsupprimerade patienter. Dock finns det vissa undantag t.ex. vid reaktiverad ögoninfektion (retinokoroidit) hos en, i övrigt, immunkompetent person och vid prenatal diagnostik av foster då antikroppsbestämning eller PCR i andra kroppsvätskor är att föredra.
Referensmetodik[redigera]
Indirekt påvisning (antikroppsbestämning)[redigera]
”Dye test” (Sabin och Feldman, 1948) har sedan länge varit "gold standard" för antikroppsbestämning vid toxoplasmos. Metoden detekterar det specifika antikroppssvaret (IgG-, IgM- och IgA-antikroppar) mot T. gondii, men används vanligen för detektion av IgG-antikroppar. Då metoden är laborativt krävande (levande parasiter används) utförs den numera endast vid ett fåtal referenslaboratorier utomlands. Istället har ett antal metoder, bland annat ett flertal kommersiella, utvecklats och validerats mot ”Dye test”. Av dessa har direkt agglutination (DA), olika ELISA:or och metoder baserade på partikelagglutination visat jämförbar prestanda för IgG-påvisning.
De flesta metoder som finns på marknaden är utvärderade mot internationella serumpaneler. Ett WHO-standardserum för inställning av olika IgG detektionstester kan erhållas från NIBSC (http://www.nibsc.ac.uk).
Agglutinationstester (DA och ISAGA) använder hela fixerade tachyzoiter som antigen, medan ELISA och partikelagglutinationsmetoderna använder lösligt antigen. Metoder baserade på indirekt immunfluorescens (IF) använder också hela fixerade tachyzoiter, men har lägre analytisk känslighet. Vid misstanke om primärinfektion bestäms specifika IgG-, IgM-, och, i vissa fall, IgA-antikroppar.
IgG-aviditet används för att bedöma om patienten lider av en akut eller kronisk infektion och bestäms med immunoenzymatiska metoder.
Prestanda[redigera]
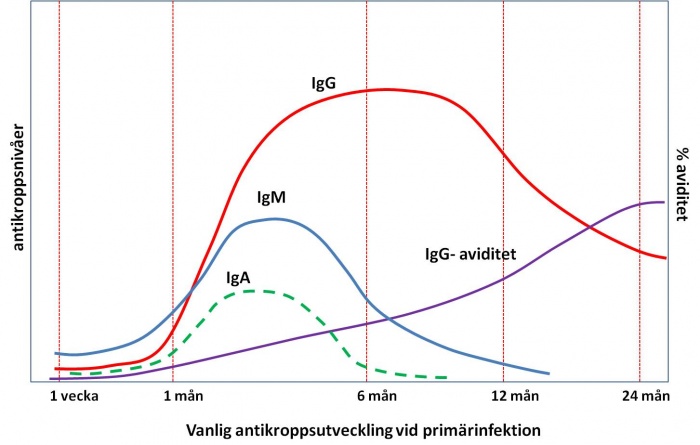
Specifika IgG- och IgM-antikroppar kan påvisas 2–3 veckor efter primärinfektion. IgG-antikroppar kan som regel påvisas livet ut, medan IgM vanligtvis avklingar under första året. Med IF kan IgM-antikroppar detekteras upp till cirka 6 månader efter primärinfektion medan känsligare metoder (ELISA, ISAGA) kan, i några få fall, påvisa IgM-antikroppar efter 12 månader. IgM-antikroppar påvisas vanligtvis inte vid reaktiverad infektion. Hos cirka 50-80 % av patienter med primärinfektion påvisas även IgA-antikroppar. IgA-antikroppar uppträder strax efter IgM-antikroppar under den primära infektionen och försvinner vanligen efter cirka 6 månader. I cirka 10 % av fallen kan de dock detekteras i mer än 12 månader.
IgG-aviditeten brukar vara låg upp till 3–6 månader efter infektion, därefter ökar den och ett högt IgG-aviditetsindex utesluter i princip en akut infektion. Observera att ett lågt aviditetsindex kan påvisas upp till ett år efter primärsmittan hos en del patienter och är i dessa fall inte en pålitlig markör för akut infektion.
Direktpåvisning (nukleinsyrapåvisning med PCR)[redigera]
PCR används för detektion av T. gondii-DNA i olika biologiska material. Fynd av parasit-DNA i exempelvis fostervatten eller cerebrospinalvätska är specifik för den kliniska diagnosen. Metoden används när antikroppsdetektion visar låg känslighet eller specificitet som vid:
- reaktiverad toxoplasmos – tillstånd då patientens antikroppsnivåer inte visar signifikanta skillnader
- immunsuppression –påverkad antikroppsproduktion
- fosterdiagnostik – påverkad antikroppsproduktion eller antikroppssvaret kan inte mätas med nuvarande metodik
PCR-metoder uppvisar generellt hög analytisk känslighet och specificitet. Under senare år har traditionell kvalitativ PCR ersatts med realtids-PCR som möjliggör kvantifiering. Olika genetiska markörer har beskrivits för detektion av Toxoplasma-DNA. PCR-metoder baserade på en repetitiv gen (B1, repetitiv 529 bp DNA-sekvens) föredras p.g.a. ökad känslighet, upp till mindre än en parasit genomkopia per PCR-reaktion.
Kvalitetssäkring[redigera]
Serologi: T. gondii är inkluderad i utskick från t. ex. INSTAND och UK-NEQAS (IgG och IgM)
PCR: QCMD Toxoplasma gondii EQA program
Svarsrutiner[redigera]
Serologi: Inga IgG/IgM antikroppar påvisade
alt. IgG/IgM antikroppar påvisade (x titer, OD-värde, internationella eller arbiträra enheter)
PCR: Inget Toxoplasma gondii-DNA påvisat / Toxoplasma gondii-DNA påvisat
Övriga diagnostiska metoder[redigera]
Odling[redigera]
Påvisande av parasiter efter isolering i celler eller i mus utförs inte längre som diagnostisk metod. Positiva odlingsresultatet kan avläsas först efter en till sex veckor och metoden har ersatts av PCR som är mindre krävande och snabbare.
Speciella diagnostiska frågeställningar[redigera]
Primär Toxoplasma-infektion hos gravida kvinnor och kongenital toxoplasmos[redigera]
Vid misstanke om primärinfektion under graviditeten undersöks serumprov från modern. Diagnostiken baseras i första hand på jämförande serologisk analys av tidigare prov (t. ex. taget på mödravårdscentral) och aktuellt prov från modern. Serokonversion (övergång från negativt till positivt antikroppssvar) under graviditeten ger en definitiv diagnos. Hos patienter som redan har antikroppar innebär en signifikant ökning av mängden IgG-antikroppar och närvaro av IgM- och/eller IgA-antikroppar sannolikt en aktuell Toxoplasma-infektion. Testning av IgG-aviditet kan också utföras för att komplettera analyserna. Ett prov som endast innehåller IgM-antikroppar behöver kontrolleras med ny provtagning efter 2-3 veckor för att konfirmera stegring av IgG-antikroppar och utesluta förekomst av falskt positiva IgM-svar.
Fostervattenundersökning med PCR kan utföras vid misstanke om kongenital infektion i fostret. Detektion av parasit-DNA i fostervatten uppvisar dock en varierande diagnostisk känslighet som påverkas av tiden mellan moderns serokonversion under graviditeten och provtagningstillfället, ju tidigare desto mindre känslighet av metoden (från ca 60 % under första trimestern till ca 80 % vid tredje trimestern).
Vid misstanke om kongenital infektion hos barnet kan navelsträngs- och/eller EDTA-blod användas för att påvisa parasit-DNA, upp till flera dagar efter födseln. Uppföljning av antikroppssvaret rekommenderas. Blodprov bör tas vid födseln och efter 1–4 veckor och analyseras för IgG-, IgM- och IgA-antikroppar. Vid svårtolkat resultat (negativ IgM och/eller IgA kan förekomma i upp till 50 % av infekterade barn) måste barnet följas upp med serologiska kontroller vid 6–12 månaders ålder.
Western blot kan också användas för att jämföra moderns och barnets antikroppssvar då påvisning av olika antikroppsmönster i dessa två prov kan vara förenligt med kongenital infektion.
Cerebral toxoplasmos[redigera]
Hos immunsupprimerade patienter med påverkad lymfocytaktivitet (t.ex. hiv och hematologiska cancersjukdomar) samt inför transplantation bör antikroppar mot T. gondii testas med en känslig IgG-screeningmetod för att undersöka om bärarskap av Toxoplasma föreligger, eftersom det finns risk för reaktivering av infektionen hos seropositiva personer med nedsatt immunförsvar.
Frånvaro av IgG-antikroppar mot Toxoplasma hos patienter med neurologiska symtom talar emot cerebral toxoplasmos medan närvaro av antikroppar kan stödja diagnosen. Dock har det rapporterats om enstaka patienter med negativ serologi och cerebral toxoplasmos.
Stegring av serumantikroppar ses sällan vid reaktivering av cerebral toxoplasmos och därför måste andra metoder användas för att bekräfta diagnosen(t.ex. PCR-analys av cerebrospinalvätska). PCR-analys på detta provmaterial kan ändå ge falskt negativt resultat beroende på om parasitskadorna är lokala eller utbredda och hur länge symtom har förekommit.
Okulär toxoplasmos[redigera]
Hos patienter med retinokoroidit rekommenderas tester för IgG- och IgM-antikroppar för att differentiera mellan primär och reaktiverad infektion. Liksom vid cerebral toxoplasmos brukar avsaknad av IgG-antikroppar kunna utesluta Toxoplasma-infektion hos de flesta fallen.
Glaskropp rekommenderas framför kammarvätska som provmaterial för PCR. Om provtagning sker tidigare än 2 veckor efter de första symtomen kan den diagnostiska känsligheten försämras. PCR-metoden ger bättre resultat för immunsupprimerade patienter än för immunkompetenta, sannolikt p.g.a. högre antal extracellulära parasiter i ögat. Som komplement kan bestämning av kvoten mellan specifika och totala IgG-antikroppar i ögonvätska och serum utföras (Goldmann-Witmer koefficient). Denna analys utförs endast vid specialiserade laboratorier.
Laboratorierapportering[redigera]
Infektion med Toxoplasma gondii är inte anmälningspliktigt enligt smittskyddslagen.
Särskild säkerhetsföreskrift föreligger för gravida vid handhavande av levande parasiter. En arbetstagare, som har underrättat arbetsgivare om att hon är gravid, får inte sysselsättas i arbete med risk för exposition för toxoplasma, om expositionen innebär risk för skadlig inverkan på graviditeten (AFS 2005:1).
Litteraturhänvisningar[redigera]
- Desmonts G, Remington J.S. Direct agglutination for test diagnosis of toxoplasma infection; method for increasing sensitivity and specificity. J Clin Microbiol 1980; 11: 486-491.
- Forsgren M, Gille E, Ljungström I, Nokes D.J., Toxoplasma gondii antibodies in pregnant women in Stockholm in 1969, 1979, and 1987. Lancet. 1991 Jun 8;337(8754):1413-4.
- Evengård B, Petersson K, Engman ML, Wiklund S, Ivarsson SA, Teär-Fahnehjelm K, Forsgren M, Gilbert R, Malm G. Low incidence of toxoplasma infection during pregnancy and in newborns in Sweden. Epidemiol Infect. 2001 Aug;127(1):121-7.
- Roberts A, Hedman K, Luyasu V, Zufferey J, Bessières MH, Blatz RM, Candolfi E, Decoster A, Enders G, Gross U, Guy E, Hayde M, Ho-Yen D, Johnson J, Lécolier B, Naessens A, Pelloux H, Thulliez P, Petersen E. Multicenter evaluation of strategies for serodiagnosis of primary infection with Toxoplasma gondii. Eur J Clin Microbiol Infect Dis. 2001 Jul;20(7):467-74.
- Thalib L, Gras L, Romand S, Prusa A, Bessieres MH, Petersen E, Gilbert RE. Prediction of congenital toxoplasmosis by polymerase chain reaction analysis of amniotic fluid. BJOG. 2005 May;112(5):567-74.
- Garweg JG, de Groot-Mijnes JD, Montoya JG. Diagnostic approach to ocular toxoplasmosis. Ocul Immunol Inflamm. 2011 Aug;19(4):255-61. Erratum in: Ocul Immunol Inflamm. 2011 Dec;19(6):456.
- Montoya JG, Parmley S, Liesenfeld O, Jaffe GJ, Remington JS. Use of the polymerase chain reaction for diagnosis of ocular toxoplasmosis. Ophthalmology. 1999 Aug;106(8):1554-63.
- Thulliez P, Remington JS. The biology and pathology of Toxoplasma gondii. Congenital Diseases Clinical Guide. Abbott, p 43.