Skillnad mellan versioner av "Leishmania spp."
| Rad 59: | Rad 59: | ||
====Visceral leishmaniasis==== | ====Visceral leishmaniasis==== | ||
| − | Mikroskopisk påvisning av amastigoter i | + | Mikroskopisk påvisning av amastigoter i utstrykspreparat från benmärg eller buffy coat efter Giemsafärgning. |
=====Avläsninigkriterier===== | =====Avläsninigkriterier===== | ||
| − | Se ovan | + | Se ovan |
| + | |||
====Förväxlings organismer:==== | ====Förväxlings organismer:==== | ||
Intracellulära ''[[Histoplasma]]''-stadier kan förekomma i blod hos immunsupprimerade eller hiv-patienter. De har samma storlek som amastigoter men deras violettfärgat kromatin, till skillnad till amastigoter, är samlat i en kropp. Svagfärgat cellvägg ger en halo-effekt och cellerna ser ut som omgivna av en tum zon. | Intracellulära ''[[Histoplasma]]''-stadier kan förekomma i blod hos immunsupprimerade eller hiv-patienter. De har samma storlek som amastigoter men deras violettfärgat kromatin, till skillnad till amastigoter, är samlat i en kropp. Svagfärgat cellvägg ger en halo-effekt och cellerna ser ut som omgivna av en tum zon. | ||
Versionen från 11 april 2012 kl. 14.56
Huvudartikel, publicerad augusti 2011, reviderad april 2012. Texten är preliminär, ännu ej beslutad genom konsensusförfarande.
Tills innehållsförteckningen för Referensmetodik:Parasitologisk diagnostik
Leishmania spp.
Smittämne
Leishmania är en encellig organism som överförs av insekter till människor eller djur. Parasiten förökar sig extracellulärt i insektens tarmkanal och intracellulärt i djur - eller humanceller. Av de drygt 20 arter, som kan infektera människa tillhör L. brasiliensis och L. donovani riskklass 3** enligt Arbetsmiljöverkets föreskrifter (AFS 2005:1).
Livscykel
Intracellulära former av Leishmania (amastigoter) tas upp av sandmyggehonor när de suger blod från infekterade människor eller djur. Amastigoter utvecklas i insektens tarmkanal till rörliga promastigoter som vandrar till salivkörtlar och sprutas in vidnästa bett. Promastigoter tas upp av makrofager och utvecklas till amastigoter. Amastigoter delar sig intracellulärt i makrofager och kan, beroende på parasitart, spridas till olika organ.
Symtom och klinisk bild
Leishmaniasis kan uppträda i olika sjukdomsformer beroende på art av Leishmania. De vanligaste sjukdomsbilderna är:
Kutan leishmaniasis (Orientböld) orsakas av bl.a. L. tropica och ses främst i Asien (Iran, Irak, Afganistan, Pakistan) och Medelhavsområdet. På platsen för insektsbettet uppträder en hudknottra som ökar i storlek och den kan så småningom övergå i ett stort sår, vilket med tiden brukar självläka.
Mukokutan leishmaniasis (Espundia) orsakas av bl. a. L. braziliensis och ses främst hos personer som vistats i Central- och Sydamerika. Sjukdomen liknar orientböld, men är oftast inte självläkande. Parasiten kan angripa och förstöra underliggande vävnader ända ner till skelettet. En infektion i ansiktet kan leda till ett vanställt utseende.
Visceral leishmaniasis (Kala-azar) orsakas av L. donovani och sjukdomen förekommer i Medelhavsområdet, Asien och Afrika. Detta är den allvarligaste formen av leishmaniasis och obehandlade patienter riskerar att dö. Sjukdomsbilden karakteriseras av feber, tilltagande avmagring samt ofta av diarré. Levern och mjälten förstoras och patienten utvecklar blodbrist.
Epidemiologi
Leishmania-arter som orsakar infektioner hos människa förekommer i ca 90 länder fördelade på alla kontinenter utom Australien och Antarktis. ”Old world Leishmania”, t.ex. L. donovani, L. infantum, L. tropica och L. major, förekommer i Afrika, Asien och runt Medelhavet. ”New world Leishmania”, som L. brasiliensis, L. mexicana och L. chagasi (L. infantum), finns i Mexiko, Central- och Sydamerika. Leishmaniasis är en vektorburen infektion där smittan överförs till människa via sandmyggor från Phlebotomus (”Old world Leishmania”)- och Lutzomyia (”New world Leishmania”)-släktena. Smittan kan spridas från människa till människa (antroponotisk spridning av t. ex L. donovani eller L. tropica) eller från djur till människa (zoonotisk spridning av t.ex. L. major eller L. brasiliensis). Djur i människans omgivning (bl.a. hundar) eller vilda djur (olika gnagare, pungdjur eller trögdjur) kan vara reservoarer vid zoonotisk spridning. Direkt spridning av human infektion utan vektor är visad vid några få tillfällen då leishmania-parasiter har överförts via blodtransfusion. Experimentella studier på hundar tyder på att spridning av L. infantum-infektion via placenta är möjlig.
I endemiska områden riskerar 350 miljoner människor Leishmania-infektion och ca 2 miljoner nya fall (varav 500 000 viscerala) förväntas årligen. En viss ökning av Leishmania-infektioner hos hiv-patienter har noterats i Sydeuropa under 80-talet och leishmaniasis räknas som den tredje mest frekventa opportunistiska parasitsjukdomen efter toxoplasmos och kryptosporidios. Förekomst av kutan leishmaniasis bland insatsstyrkor i Afganistan och Irak tyder på ett klart samband mellan frekventa sandmyggebett och infektion. Inkubationstiden varierar och är ofta lång, månader till år. Infektionsdosen för människa är inte definierad. Smittspridning förekommer inte i Sverige men infektioner har diagnostiserats hos personer som vistats i Medelhavsområdet och i tropiska och subtropiska områden i andra delar av världen.
Provtagning och transport
Provmaterial
- hudbiopsi (hudstans) eller hudskrap
- aspirat från sår, benmärg, mjälte eller lymfkörtel
- EDTA-blod
- serum
- utstryk från hudskrap, såraspirat eller benmärg
- imprintpreparat från hudbiopsi
Provtagning
Förvaring/transport
Provmaterialet för odling läggs sterilt i RPMI-medium och skickas omedelbart för laboratoriediagnostik.
Laboratoriediagnostik
Allmänt
Diagnostiken baserar sig på direkt identifiering av parasitstadier i utstryk (amastigoter) eller efter in vitro odling i specifika medier (promastigoter). Sensitivitet av mikroskopi är lägre eller lika hög som vid isolering. Artbestämning är inte möjligt vid mikroskopisk påvisning av parasiter - för detta krävs typning efter odling eller PCR.
Referensmetodik
Kutan leishmaniasis
Mikroskopisk påvisning av amastigoter i ett preparat efter Giemsafärgning. Utstryk på glas kan göras från såraspirat eller hudskrap. Inprintpreparat från hudbiopsi görs genom att trycka den mot ett objektglas. Lufttorkade preparat fixeras i metanol och färgas med Giemsafärg (bilaga PAR 09).
Avläsningskriterier
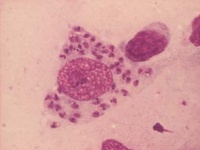
Både intra- och extracellulära amastigoter kan finnas i preparat. Amastigoter är 3-5µm, runda eller ovala, har stor kärna och liten kinetoplast som färgas violetta och cytoplasma som färgas blå.
Visceral leishmaniasis
Mikroskopisk påvisning av amastigoter i utstrykspreparat från benmärg eller buffy coat efter Giemsafärgning.
Avläsninigkriterier
Se ovan
Förväxlings organismer:
Intracellulära Histoplasma-stadier kan förekomma i blod hos immunsupprimerade eller hiv-patienter. De har samma storlek som amastigoter men deras violettfärgat kromatin, till skillnad till amastigoter, är samlat i en kropp. Svagfärgat cellvägg ger en halo-effekt och cellerna ser ut som omgivna av en tum zon.
Kvalitetssäkring
Identifiering av Leishmania amastigoter i utstryk ingår i NEQAS-utskick.
Svarsrutiner
Amastigoter av Leishmania påvisade
Inga amastigoter av Leishmania påvisade i Giemsafärgat utstrykpreparat.
Övriga diagnostiska metoder
- In vitro odling av material från hudbiopsi, benmärg, buffy coat, mjältaspirat i Novy, Mac Neal och Nicolle medium (NNN) eller/och RPMI medium. Sannolikhet för att påvisa Leishmania parasiter i odling vid visceral infektion är beroende på provmaterialet; den är störst med 1) mjälte 2) benmärg 3) lymfkörtel och 4) buffycoat. Det är viktigt att biopsimaterial för odling hanteras sterilt. Kontamination vid provtagning orsakar bakterie- eller svampöverväxt och hämmar utveckling av Leishmania-promastigoter. Finfördelad vävnadsmaterial inkuberas i odlingsmedium i 23°C. Amastigoter som finns i provmaterial utvecklas till promastigoter. Utstryk från odling kan färgas med Giemsafärg.
- PCR- baserade metoder för påvisning av parasit-DNA. Olika metoder (enkel, nested, realtids-PCR) och olika gener har använts. Conserved region of the minicircle molecule (kinetoplastid mitochondrial DNA) och ITS of nuclear, ribosomal DNA används oftast som targets.
- Serologiska metoder för påvisning av antikroppar i serum har hög sensitivitet vid visceral Leishmania-infektion. Patienter som sedan tidigare är hiv -infekterade kan få påverkat antikroppssvar. Vid fall av kutan Leishmania-infektion kan antikroppsvaret bli svagt eller negativt. Många olika tester, som utnyttjar olika antigener finns beskrivna: IF med odlade promastigot- eller amastigotstadier, Elisa med extrakt från odlade parasiter eller med rekombinanta antigener, direktagglutination.
- Kommersiella tester för detektion av antikroppar har utvärderats och rekommenderas som känsliga och specifika metoder att använda i vissa endemiska områden:
1. Indirekt haemagglutination (IHA, Behring Diagnostics, GmbH,Marburg, Tyskland)
2. Indirect Immunofluorescent antibody assay (IFA, bioMerieux sa, Marcy l`Etoile, Frankrike)
3. Immunkromatografiska tester med recombinant antigen rK39 (strip-test, Intersep Ltd, Berkshire, England; inBios, Seattle, WA, USA; IT-Leish, Diamed, AG)
4. Direkt agglutination (DAT) med standardiserad FD antigen (Prince Leopold Instituten of Tropical Medicine, Antwerp,Belgien; Royal Tropical Institute, Amsterdam, Holland)
- Artbestämning kan ge en viktig information till behandling av infektioner med ”New world leishmanier”. Typning kan göras med PCR-RFLP, PCR-sekvensering, med monoklonala antikroppar efter in vitro odling, eller med isoenzymatisk analys.
- Latex agglutination test för antigen detektion i urin vid misstänkt visceralinfektion.
Laboratorierapportering
Infektion med Leishmania är inte anmälningspliktig.
Litteraturhänvisningar
- Ready PD. Leishmaniasis emergence in Europé. EuroSurveill. 2010, 15 (10): 19505.
- Rodriguez-Cortes A, Ojeda A, Francino O, Lopez-Fuertes L, Timon M, Alberola J. Leishmania infection: laboratory diagnosing in the absence of a “gold standard”. Am. J. Trop. Med. Hyg. 2010, 82(2): 251-6.
- Pratlong F, Dereure J, Ravel Ch, Lami P, Balard Y, Serres G, Lanotte G, Rioux J-A, Dedet J-P. Geographical distribution and epidemiological features of Old World cutaneous leishmaniasis foci, based on the isoenzyme analysis of 1048 strains. Trop. Med. Intern. Health 2009, 14(9): 1071-85.
- Iqbal J, Hira PR, Saroj G, Philip R, Al-Ali F, Madda PJ, Sher A. Imported visceral leishmaniasis: diagnostic dilemmas and comparative analysis of three assays. J. Clin. Microbiol. 2002, 40(2): 475-9.
- Sundar S, Singh RK, Maurya R, kumar B, Chhabra A, Singh V, Rai M. Serological diagnosis of Indian visceral leishmaniasis: direct agglutination test versus rK39 strip test. Trans. Roy. Soc. Trop. Med. Hyg. 2006, 100:533-7.
- WHO. Leishmaniasis:background information, a brief history of the disease. WHO. 2009. [1]
- Fauld M, Schrader J, Heyl G, Amirih M, Hoerauf A. Zoonotic cutaneous leishmaniasis outbreak in Mazar-e Sharif, northern Afganistan: an epidemiological evaluation. Int. J. Med. Microbiol. 2008, 543-550.