Skillnad mellan versioner av "PAR 09 Malariamikroskopi"
| (49 mellanliggande sidversioner av en annan användare visas inte) | |||
| Rad 1: | Rad 1: | ||
| − | '''Huvudartikel''' publicerad april 2012 | + | '''Huvudartikel''', publicerad april 2012. |
--------------- | --------------- | ||
''Till innehållsförteckningen för [[Referensmetodik:Parasitologisk diagnostik]] | ''Till innehållsförteckningen för [[Referensmetodik:Parasitologisk diagnostik]] | ||
och | och | ||
| − | ''[[Referensmetodik:Smittskyddslagens sjukdomar]]'' med | + | ''[[Referensmetodik:Smittskyddslagens sjukdomar]]'' med Folkhälsomyndighetens falldefinition i artikeln [[Malaria]] |
| + | ------ | ||
==Mikroskopisk påvisning av malariaparasiter== | ==Mikroskopisk påvisning av malariaparasiter== | ||
| Rad 18: | Rad 19: | ||
Tjock droppe och utstryk på objektglas eller nytaget EDTA-blod. EDTA-blod bör inte vara äldre än 6 timmar. Heparinblod accepteras inte. | Tjock droppe och utstryk på objektglas eller nytaget EDTA-blod. EDTA-blod bör inte vara äldre än 6 timmar. Heparinblod accepteras inte. | ||
===Provtransport=== | ===Provtransport=== | ||
| − | Malaria-mikroskopi är vanligtvis ett akutprov och provtagning sker lämpligen på infektionsklinik där det finns möjlighet att utföra mikroskopi lokalt (alternativt snabb transport till ett parasitlaboratorium) Om det blir aktuellt att skicka prov med längre transporttid än några timmar skall tjock droppe och utstryk göras från EDTA-blod. Preparat som är helt torra läggs i transporthylsa för objektglas. Observera att det är mycket viktigt att tjocka droppen fått torka helt innan den läggs i transporthylsan. | + | Malaria-mikroskopi är vanligtvis ett akutprov och provtagning sker lämpligen på infektionsklinik där det finns möjlighet att utföra mikroskopi lokalt (alternativt snabb transport till ett parasitlaboratorium). Om det blir aktuellt att skicka prov med längre transporttid än några timmar skall tjock droppe och utstryk göras från EDTA-blod. Preparat som är helt torra läggs i transporthylsa för objektglas. Observera att det är mycket viktigt att tjocka droppen fått torka helt innan den läggs i transporthylsan. |
| + | |||
===Speciell utrustning=== | ===Speciell utrustning=== | ||
Dragskåp alternativt dragbänk | Dragskåp alternativt dragbänk | ||
| + | |||
Ljusmikroskop med immersionsobjektiv 100x och 50x | Ljusmikroskop med immersionsobjektiv 100x och 50x | ||
| + | |||
===Reagenser=== | ===Reagenser=== | ||
| − | * | + | *metanol 99,8% |
*Giemsa stocklösning (Giemsa azur-eosin-metylenblå lösning) | *Giemsa stocklösning (Giemsa azur-eosin-metylenblå lösning) | ||
| − | * | + | *fosfatbuffert pH 7,2 (enligt ref 2) |
| − | + | :di-Natriumvätefosfat Na<sub><small>2</small></sub>HPO<sub><small>4</small></sub> 1,0 g | |
| − | + | :kaliumdivätefosfat KH<sub><small>2</small></sub>PO<sub><small>4</small></sub> 0,7 g | |
| − | + | :destillerat vatten till 1000 mL | |
| − | Kontrollera pH. | + | :Kontrollera pH. |
*Field's stain A (Metylenblått-azur) | *Field's stain A (Metylenblått-azur) | ||
*Field's stain B (Eosin) | *Field's stain B (Eosin) | ||
| − | Field's stain A och B finns att köpa t ex från DiaSys Ltd i England | + | :Field's stain A och B finns att köpa t ex från DiaSys Ltd i England |
*Immersionsolja för ljusmikroskopi | *Immersionsolja för ljusmikroskopi | ||
| + | |||
===Analysprocedur=== | ===Analysprocedur=== | ||
Beredning av tjock droppe och tunt utstryk görs på nytaget EDTA-blod. | Beredning av tjock droppe och tunt utstryk görs på nytaget EDTA-blod. | ||
Arbetet utförs i säkerhetsbänk. Använd handskar. Blanda EDTA-röret noggrant och märk 4 objektglas med mattfält med provnummer. | Arbetet utförs i säkerhetsbänk. Använd handskar. Blanda EDTA-röret noggrant och märk 4 objektglas med mattfält med provnummer. | ||
====Tjock droppe==== | ====Tjock droppe==== | ||
| − | 1. Sug upp en droppe blod (10 µL) Lägg droppen mitt på ett objektglas. Rör ut droppen till ca 1,5 cm i diameter. Gör dubbelprov. | + | 1. Sug upp en droppe blod (10 µL). Lägg droppen mitt på ett objektglas. Rör ut droppen till ca 1,5 cm i diameter. Gör dubbelprov. |
| + | |||
| + | 2. Låt torka minst 60 min i rumstemperatur eller 5-15 min i värmeskåp (37° C). | ||
| − | |||
====Tunt utstryk==== | ====Tunt utstryk==== | ||
1. Sätt en liten droppe blod (ca 5 µL) vid mattkanten på ett objektglas. Håll ett utstryksglas mot droppen och när den spridit sig efter hela kanten förs utstryksglaset över objektglaset så att ett tunt utstryk bildas. Gör dubbelprov. | 1. Sätt en liten droppe blod (ca 5 µL) vid mattkanten på ett objektglas. Håll ett utstryksglas mot droppen och när den spridit sig efter hela kanten förs utstryksglaset över objektglaset så att ett tunt utstryk bildas. Gör dubbelprov. | ||
| − | 2. Låt torka. | + | 2. Låt torka i rumstemperarur. |
| + | |||
====Färgning==== | ====Färgning==== | ||
Arbetet utförs i dragskåp eller dragbänk. | Arbetet utförs i dragskåp eller dragbänk. | ||
| − | =====Alternativ 1 Färgning med Giemsa===== | + | =====Alternativ 1: Färgning med Giemsa===== |
Använd nyberedd Giemsa-lösning vid varje färgningstillfälle. | Använd nyberedd Giemsa-lösning vid varje färgningstillfälle. | ||
Späd till 5–10 % med fosfatbuffert pH 7,2. Se under anmärkning. | Späd till 5–10 % med fosfatbuffert pH 7,2. Se under anmärkning. | ||
| Rad 76: | Rad 83: | ||
Styrka och tid för Giemsafärgning varierar stort i olika publikationer. Det är därför viktigt att testa ut optimal koncentration och tid för det egna behovet. Generellt gäller att ju högre koncentration av Giemsafärg man använder desto kortare färgningstid. | Styrka och tid för Giemsafärgning varierar stort i olika publikationer. Det är därför viktigt att testa ut optimal koncentration och tid för det egna behovet. Generellt gäller att ju högre koncentration av Giemsafärg man använder desto kortare färgningstid. | ||
| − | =====Alternativ 2 Färgning med Field’s stain (modifierat efter ref 3)===== | + | |
| + | =====Alternativ 2: Färgning med Field’s stain (modifierat efter ref 3)===== | ||
'''Tjock droppe''' | '''Tjock droppe''' | ||
| Rad 86: | Rad 94: | ||
2. Skölj av färglösningen försiktigt i en bägare med svagt rinnande kranvatten. | 2. Skölj av färglösningen försiktigt i en bägare med svagt rinnande kranvatten. | ||
| − | OBS! Rikta aldrig vattenstrålen direkt mot tjocka droppen. | + | :OBS! Rikta aldrig vattenstrålen direkt mot tjocka droppen. |
3. Doppa glaset i Field’s stain B i 4–5 sekunder. | 3. Doppa glaset i Field’s stain B i 4–5 sekunder. | ||
| Rad 92: | Rad 100: | ||
4. Skölj av färglösningen försiktigt i en bägare med svagt rinnande kranvatten. | 4. Skölj av färglösningen försiktigt i en bägare med svagt rinnande kranvatten. | ||
| − | OBS! Rikta aldrig vattenstrålen direkt mot tjocka droppen. | + | :OBS! Rikta aldrig vattenstrålen direkt mot tjocka droppen. |
| − | |||
5. Låt torka stående. | 5. Låt torka stående. | ||
| Rad 123: | Rad 130: | ||
'''Räkning av antal malariaplasmodier i tunt utstryk''' | '''Räkning av antal malariaplasmodier i tunt utstryk''' | ||
| − | Vid positivt prov som innehåller | + | Vid positivt prov som innehåller trofozoitformer av ''Plasmodium falciparum'' skall det procentuella antalet infekterade erytrocyter räknas i tunt utstryk. Se under rubrik ”Räkning av antalet malaria-infekterade erytrocyter i tunt utstryk". |
| − | + | ||
====Kvalitetssäkring==== | ====Kvalitetssäkring==== | ||
=====Intern===== | =====Intern===== | ||
Leukocyternas utseende observeras i varje preparat. På så sätt blir varje preparat sin egen internkontroll. | Leukocyternas utseende observeras i varje preparat. På så sätt blir varje preparat sin egen internkontroll. | ||
| − | För bildmaterial se (ref 4, 5, 6, 7). Referens 6 innefattar även ''Plasmodium knowlesi''. | + | För bildmaterial se (ref. 4, 5, 6, 7). Referens 6 innefattar även '' [[Plasmodium spp. (Malaria)|Plasmodium knowlesi]] ''. |
| + | |||
'''Internt referensmaterial''': Panel bestående av sparade interna positiva preparat samt preparat från UK-NEQAS | '''Internt referensmaterial''': Panel bestående av sparade interna positiva preparat samt preparat från UK-NEQAS | ||
| + | |||
=====Extern===== | =====Extern===== | ||
| − | Malariaparasiter ingår i UK-NEQAS blodutskick. | + | Malariaparasiter ingår i UK-NEQAS blodutskick. |
| + | |||
====Prestanda==== | ====Prestanda==== | ||
Vid granskning av 200 synfält med objektiv 100x (motsvarar ca 0,2 µL blod) i tjock droppe blir känsligheten cirka 15 parasiter per µL (ref 8). | Vid granskning av 200 synfält med objektiv 100x (motsvarar ca 0,2 µL blod) i tjock droppe blir känsligheten cirka 15 parasiter per µL (ref 8). | ||
| Rad 140: | Rad 150: | ||
=====Positivt prov===== | =====Positivt prov===== | ||
Malariaplasmodier påvisade. Ange species och utvecklingsstadium (d.v.s. skilj på sexuella och asexuella former). | Malariaplasmodier påvisade. Ange species och utvecklingsstadium (d.v.s. skilj på sexuella och asexuella former). | ||
| − | *Ex 1: Ringformer av ''Plasmodium falciparum'' | + | *Ex 1: Ringformer av '' [[Plasmodium spp. (Malaria)|Plasmodium falciparum]] '' (ange dessutom alltid parasitemi i % av infekterade erytrocyter) |
| − | *Ex 2: Alla former av ''Plasmodium vivax'' | + | *Ex 2: Alla former av '' [[Plasmodium spp. (Malaria)|Plasmodium vivax]] '' |
*Ex 3. Gametocyter av ''Plasmodium falciparum'' påvisade. | *Ex 3. Gametocyter av ''Plasmodium falciparum'' påvisade. | ||
Om artbestämning inte är möjlig: Enstaka malariaplasmodier påvisade i tjock droppe. Artbestämning inte möjlig p. g. a. av låg parasitemi. | Om artbestämning inte är möjlig: Enstaka malariaplasmodier påvisade i tjock droppe. Artbestämning inte möjlig p. g. a. av låg parasitemi. | ||
| − | Observera att det morfologiskt inte går att skilja ''P. malariae'' från ''P. knowlesi''. I förekommande fall (patienter från områden där båda species förekommer) skall detta framgå av svaret, samt att PCR rekommenderas för artbestämning. | + | |
| + | Observera att det morfologiskt inte går att skilja '' [[Plasmodium spp. (Malaria)|P. malariae]]'' från ''P. knowlesi''. I förekommande fall (patienter från områden där båda species förekommer) skall detta framgå av svaret, samt att PCR rekommenderas för artbestämning. | ||
==Litteraturhänvisningar== | ==Litteraturhänvisningar== | ||
| Rad 166: | Rad 177: | ||
==Räkning av antalet malaria-infekterade erytrocyter i tunt utstryk== | ==Räkning av antalet malaria-infekterade erytrocyter i tunt utstryk== | ||
| − | + | ===Speciell utrustníng=== | |
Mikroskop med räkneokular | Mikroskop med räkneokular | ||
| − | Arbetsprocedur | + | |
| + | ===Arbetsprocedur=== | ||
1. Välj ett område i ett Giemsa-färgat tunt utstryk där erytrocyterna ligger jämnt fördelade. | 1. Välj ett område i ett Giemsa-färgat tunt utstryk där erytrocyterna ligger jämnt fördelade. | ||
| + | |||
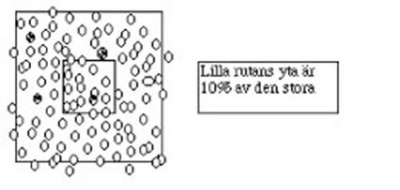
2. Den inre lilla rutan utgör en tiondel av den yttre rutan. Räkna alla erytrocyter inuti den inre rutan samt de som finns på två av sidolinjerna av den inre rutan. | 2. Den inre lilla rutan utgör en tiondel av den yttre rutan. Räkna alla erytrocyter inuti den inre rutan samt de som finns på två av sidolinjerna av den inre rutan. | ||
| + | |||
| + | [[Fil:Dok1.jpg|thumb|400px| left| ]] | ||
| + | |||
| + | 3. Räkna samtidigt antalet infekterade erytrocyter i den stora rutan plus två kanter. Räkna även med den lilla inre rutan. | ||
| + | |||
| + | 4. Fortsätt i preparatet enligt punkt 2 och 3 tills 300–500 erytrocyter i lilla rutan är räknade. Då är 3000–5000 erytrocyter granskade med avseende på parasiter. | ||
| − | |||
| − | |||
5. Uträkning: Antal infekterade erytrocyter x 100/Antal granskade erytrocyter = % infekterade erytrocyter. | 5. Uträkning: Antal infekterade erytrocyter x 100/Antal granskade erytrocyter = % infekterade erytrocyter. | ||
| − | Räkneexempel | + | |
| + | '''Räkneexempel''': | ||
Du har räknat till 450 erytrocyter i den inre rutan. Detta innebär att 4500 erytrocyter är granskade. Du har samtidigt räknat till 80 infekterade erytrocyter i hela stora rutan inklusive den inre. | Du har räknat till 450 erytrocyter i den inre rutan. Detta innebär att 4500 erytrocyter är granskade. Du har samtidigt räknat till 80 infekterade erytrocyter i hela stora rutan inklusive den inre. | ||
| − | Uträkning: 80 x 100/4500=1,8 % infekterade erytrocyter | + | |
| − | OBS | + | '''Uträkning''': 80 x 100/4500=1,8 % infekterade erytrocyter |
| − | Utsvar: x % erytrocyter infekterade med Plasmodium falciparum. | + | |
| − | + | OBS! Om en erytrocyt innehåller 2 plasmodier räknas den fortfarande som en infekterad erytrocyt. | |
| + | |||
| + | '''Utsvar''': x % erytrocyter infekterade med ''Plasmodium falciparum''. | ||
| + | |||
| + | ==Litteraturhänvisningar== | ||
Carl Zeiss Svenska AB: Inställbart okular med okularstreckplatta för retikulocyträkning. | Carl Zeiss Svenska AB: Inställbart okular med okularstreckplatta för retikulocyträkning. | ||
[[Kategori:Smittskyddslagens sjukdomar]] | [[Kategori:Smittskyddslagens sjukdomar]] | ||
[[Kategori:Parasiter]] | [[Kategori:Parasiter]] | ||
| + | [[Kategori:Laboratoriediagnostik]] | ||
| + | [[Kategori:Laboratoriediagnostik-parasiter]] | ||
Nuvarande version från 18 oktober 2016 kl. 17.01
Huvudartikel, publicerad april 2012.
Till innehållsförteckningen för Referensmetodik:Parasitologisk diagnostik
och Referensmetodik:Smittskyddslagens sjukdomar med Folkhälsomyndighetens falldefinition i artikeln Malaria
Mikroskopisk påvisning av malariaparasiter[redigera]
Analysprincip/teststrategi[redigera]
Tjock droppe
Några droppar blod rörs ut på ett objektglas och får torka. Färgas utan föregående fixering med buffrad Giemsalösning alternativt med Field’s stain varvid erytrocyterna hemolyserar. Glaset sköljs försiktigt, får torka och granskas i ljusmikroskop. Malariaplasmodiernas kärna färgas röd och deras cytoplasma blå. Tjock droppe används främst för att påvisa förekomst av malariaplasmodier.
Tunt utstryk
En droppe blod stryks ut på objektglas, får torka, metanolfixeras och färgas med Giemsa-lösning. Tunt utstryk används främst för att bestämma species vid positiva fynd samt för räkning av antalet infekterade erytrocyter.
Provmaterial[redigera]
Tjock droppe och utstryk på objektglas eller nytaget EDTA-blod. EDTA-blod bör inte vara äldre än 6 timmar. Heparinblod accepteras inte.
Provtransport[redigera]
Malaria-mikroskopi är vanligtvis ett akutprov och provtagning sker lämpligen på infektionsklinik där det finns möjlighet att utföra mikroskopi lokalt (alternativt snabb transport till ett parasitlaboratorium). Om det blir aktuellt att skicka prov med längre transporttid än några timmar skall tjock droppe och utstryk göras från EDTA-blod. Preparat som är helt torra läggs i transporthylsa för objektglas. Observera att det är mycket viktigt att tjocka droppen fått torka helt innan den läggs i transporthylsan.
Speciell utrustning[redigera]
Dragskåp alternativt dragbänk
Ljusmikroskop med immersionsobjektiv 100x och 50x
Reagenser[redigera]
- metanol 99,8%
- Giemsa stocklösning (Giemsa azur-eosin-metylenblå lösning)
- fosfatbuffert pH 7,2 (enligt ref 2)
- di-Natriumvätefosfat Na2HPO4 1,0 g
- kaliumdivätefosfat KH2PO4 0,7 g
- destillerat vatten till 1000 mL
- Kontrollera pH.
- Field's stain A (Metylenblått-azur)
- Field's stain B (Eosin)
- Field's stain A och B finns att köpa t ex från DiaSys Ltd i England
- Immersionsolja för ljusmikroskopi
Analysprocedur[redigera]
Beredning av tjock droppe och tunt utstryk görs på nytaget EDTA-blod. Arbetet utförs i säkerhetsbänk. Använd handskar. Blanda EDTA-röret noggrant och märk 4 objektglas med mattfält med provnummer.
Tjock droppe[redigera]
1. Sug upp en droppe blod (10 µL). Lägg droppen mitt på ett objektglas. Rör ut droppen till ca 1,5 cm i diameter. Gör dubbelprov.
2. Låt torka minst 60 min i rumstemperatur eller 5-15 min i värmeskåp (37° C).
Tunt utstryk[redigera]
1. Sätt en liten droppe blod (ca 5 µL) vid mattkanten på ett objektglas. Håll ett utstryksglas mot droppen och när den spridit sig efter hela kanten förs utstryksglaset över objektglaset så att ett tunt utstryk bildas. Gör dubbelprov.
2. Låt torka i rumstemperarur.
Färgning[redigera]
Arbetet utförs i dragskåp eller dragbänk.
Alternativ 1: Färgning med Giemsa[redigera]
Använd nyberedd Giemsa-lösning vid varje färgningstillfälle. Späd till 5–10 % med fosfatbuffert pH 7,2. Se under anmärkning.
Tjock droppe
OBS! Tjock droppe färgas ofixerad.
1. Lägg objektglaset på ett färgningsställ. Täck glaset med Giemsa-lösning. Färga 10–20 minuter.
2. Skölj av färglösningen mycket försiktigt i en bägare med kranvatten alternativt under svagt rinnande vatten. OBS! Rikta aldrig vattenstrålen direkt mot tjocka droppen.
3. Låt torka stående.
Tunt utstryk
1. Fixera tunt utstryk ca 30 sekunder i absolut metanol (kyvett i dragbänk eller dragskåp).
2. Låt lufttorka.
3. Lägg objektglaset på ett färgningsställ. Täck glaset med Giemsa-lösning. Färga 10–20 minuter. Se under anmärkning.
4. Skölj väl i kranvatten.
5. Låt torka stående.
Anmärkning Giemsafärgning
Styrka och tid för Giemsafärgning varierar stort i olika publikationer. Det är därför viktigt att testa ut optimal koncentration och tid för det egna behovet. Generellt gäller att ju högre koncentration av Giemsafärg man använder desto kortare färgningstid.
Alternativ 2: Färgning med Field’s stain (modifierat efter ref 3)[redigera]
Tjock droppe
Gör iordning 2 kyvetter med lock: en med Field’s stain A och en med Field’s stain B. Innehållet i kyvetterna byts var 14:e dag.
1. Doppa objektglaset i kyvett A i 5 sekunder. Erytrocyterna hemolyserar.
2. Skölj av färglösningen försiktigt i en bägare med svagt rinnande kranvatten.
- OBS! Rikta aldrig vattenstrålen direkt mot tjocka droppen.
3. Doppa glaset i Field’s stain B i 4–5 sekunder.
4. Skölj av färglösningen försiktigt i en bägare med svagt rinnande kranvatten.
- OBS! Rikta aldrig vattenstrålen direkt mot tjocka droppen.
5. Låt torka stående.
Tunt utstryk
Färgning av tunt utstryk med Field’s stain kan utföras om snabb identifiering av species önska. I förekommande fall rekommenderas kompletterande färgning med Giemsa. Använd nyberedd Field’s stain B spädd 1+3 med fosfatbuffert vid varje färgningstillfälle.
1. Fixera utstryket 30 sekunder i metanol (kyvett i dragbänk eller dragskåp).
2. Låt utstryket lufttorka.
3. Lägg glaset på ett färgningsställ. Låt 1 ml Field’s stain B spädd 1+3 med fosfatbuffert flöda över preparatet.
4. 1 mL av ospädd Field’s stain A sätts till och blandas genast med lösning B.
5. Färga 1 minut.
6. Skölj väl i kranvatten.
7. Låt torka stående.
Bedömning av prov[redigera]
Granskning av tjock droppe[redigera]
Malariaplasmodier påvisas i tjock droppe. Hela droppen kan initialt screenas med objektiv 50x och misstänkta objekt verifieras med 100x. Minst 200 synfält skall observeras med objektiv 100x innan provet bedöms som negativt.
Granskning av tunt utstryk[redigera]
Plasmodiernas utseende i tunt utstryk i kombination med utseendet i tjock droppe ligger till grund för typning av malariaspecies.
Räkning av antal malariaplasmodier i tunt utstryk
Vid positivt prov som innehåller trofozoitformer av Plasmodium falciparum skall det procentuella antalet infekterade erytrocyter räknas i tunt utstryk. Se under rubrik ”Räkning av antalet malaria-infekterade erytrocyter i tunt utstryk".
Kvalitetssäkring[redigera]
Intern[redigera]
Leukocyternas utseende observeras i varje preparat. På så sätt blir varje preparat sin egen internkontroll. För bildmaterial se (ref. 4, 5, 6, 7). Referens 6 innefattar även Plasmodium knowlesi .
Internt referensmaterial: Panel bestående av sparade interna positiva preparat samt preparat från UK-NEQAS
Extern[redigera]
Malariaparasiter ingår i UK-NEQAS blodutskick.
Prestanda[redigera]
Vid granskning av 200 synfält med objektiv 100x (motsvarar ca 0,2 µL blod) i tjock droppe blir känsligheten cirka 15 parasiter per µL (ref 8). Specificiteten är vanligtvis hög, men kan vara relativt låg vid mycket låga parasitemier samt vid blandinfektion, speciellt när en Plasmodium-art överväger. Se också nedan under svarsrutin för P. malariae/P. knowlesi.
Svarsrutin[redigera]
Negativt prov[redigera]
Inga malariaplasmodier påvisade.
Positivt prov[redigera]
Malariaplasmodier påvisade. Ange species och utvecklingsstadium (d.v.s. skilj på sexuella och asexuella former).
- Ex 1: Ringformer av Plasmodium falciparum (ange dessutom alltid parasitemi i % av infekterade erytrocyter)
- Ex 2: Alla former av Plasmodium vivax
- Ex 3. Gametocyter av Plasmodium falciparum påvisade.
Om artbestämning inte är möjlig: Enstaka malariaplasmodier påvisade i tjock droppe. Artbestämning inte möjlig p. g. a. av låg parasitemi.
Observera att det morfologiskt inte går att skilja P. malariae från P. knowlesi. I förekommande fall (patienter från områden där båda species förekommer) skall detta framgå av svaret, samt att PCR rekommenderas för artbestämning.
Litteraturhänvisningar[redigera]
1. Shute GT. The microscopic diagnosis of malaria. In Malaria, Principles and Practice of Malariology. Ed WH Wernsdorfer and J Mc Gregor. London Churchill Livingstone 1988;781-814.
4. Ash L, Orihel C. Atlas of Human Parasitology. ASCP Press, Chicago.
5. WHO Bench Aids for the Diagnosis of Malaria Infections.
6. http://www.dpd.cdc.gov/dpdx/html/imagelibrary/malaria_il.htm
7. Chiodini PL, Moody AH, Manser DW. Atlas of Medical Helminthology and Protozoology. Harcourt Publishers, Churchill Livingstone. http://www.mediafire.com/?zmmtoehumz2
8. Hellgren U, Ericsson Ö, Kihamia CM, Rombo L. Malaria parasites and chloroquine concentrations in Tanzanian school children. Trop Med Parasitol 1994;45:293-297.
Räkning av antalet malaria-infekterade erytrocyter i tunt utstryk[redigera]
Speciell utrustníng[redigera]
Mikroskop med räkneokular
Arbetsprocedur[redigera]
1. Välj ett område i ett Giemsa-färgat tunt utstryk där erytrocyterna ligger jämnt fördelade.
2. Den inre lilla rutan utgör en tiondel av den yttre rutan. Räkna alla erytrocyter inuti den inre rutan samt de som finns på två av sidolinjerna av den inre rutan.
3. Räkna samtidigt antalet infekterade erytrocyter i den stora rutan plus två kanter. Räkna även med den lilla inre rutan.
4. Fortsätt i preparatet enligt punkt 2 och 3 tills 300–500 erytrocyter i lilla rutan är räknade. Då är 3000–5000 erytrocyter granskade med avseende på parasiter.
5. Uträkning: Antal infekterade erytrocyter x 100/Antal granskade erytrocyter = % infekterade erytrocyter.
Räkneexempel: Du har räknat till 450 erytrocyter i den inre rutan. Detta innebär att 4500 erytrocyter är granskade. Du har samtidigt räknat till 80 infekterade erytrocyter i hela stora rutan inklusive den inre.
Uträkning: 80 x 100/4500=1,8 % infekterade erytrocyter
OBS! Om en erytrocyt innehåller 2 plasmodier räknas den fortfarande som en infekterad erytrocyt.
Utsvar: x % erytrocyter infekterade med Plasmodium falciparum.
Litteraturhänvisningar[redigera]
Carl Zeiss Svenska AB: Inställbart okular med okularstreckplatta för retikulocyträkning.