Coronavirus (SARS-CoV)
Huvudartikel publicerad 2005, uppdaterad 2010
Till innehållsförteckningen för Referensmetodik: Nedre luftvägsinfektioner, 2:a upplagan 2005
och
Referensmetodik:Smittskyddslagens sjukdomar
Smittämnen
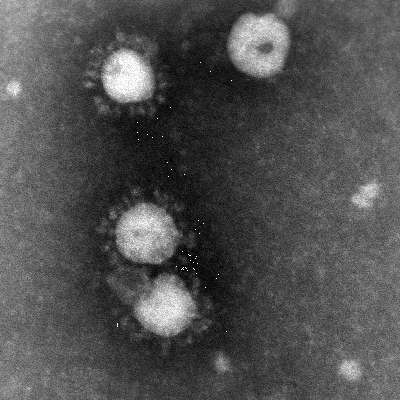
Coronavirus är höljebärande RNA-virus med stor benägenhet att förändras genom mutationer och rekombinationer. Virus har fått sitt namn på grund av att utskott från höljet ser ut som en ”corona” i elektronmikroskopet (figur 15). Coronavirus indelas i tre undergrupper, och det finns många coronavirus hos däggdjur. De kan orsaka diverse svåra sjukdomar hos olika djurvärdar. Fram till 2003 kände man endast till två coronavirus som drabbade människa, 229E och OC43. Båda är vanlig orsak till övre luftvägsinfektion. I mars 2003 identifierades ett dittills helt okänt coronavirus hos patienter med svår akut respiratorisk sjukdom (SARS). Det döptes så småningom till SARS Coronavirus (SARS-CoV). Virus var genetiskt skilt från tidigare identifierade coronavirus. Sannolikt har det sitt ursprung bland något av de många smådjur som säljs på matmarknader i södra Kina, men man vet inte exakt vilket. Virus verkar dåligt anpassat till humana celler, men under epidemin 2003 förändrades det receptor-bindande proteinutskottet (spikeprotein; ”taggproteinet”) på några månader. Detta skedde sannolikt genom att en klon som var bättre anpassad till receptorn på mänskliga celler (angiotensin- converting enzym 2) selekterades. SARS-virus har inte identifierats hos människor sedan 2004, och risken för spridning av virus från 2003 anses nu vara över. Ny överföring från djur till människa är dock inte utesluten. SARS ökade intresset för coronavirus, och 2004 identifierades ett nytt, humant coronavirus som ger luftvägsinfektion. Coronavirus är känsliga för bl.a. värme, lösningsmedel, detergens och formaldehyd, men relativt okänsligt för pH-förändringar. Infekterat material kan vara smittsamt i flera dagar.
Patogenes och patofysiologi
Virus infekterar genom luftvägarna, och ger initialt upphov till en kortvarig viremi som orsakar feber och sjukdomskänsla. Efter några dagar till någon vecka vidtar ibland en massiv och tilltagande virusreplikation i lungorna. Denna ger upphov till en intensiv immunologisk reaktion, som tyvärr ofta varit ineffektiv när det gäller att eliminera virus. Virus kan påvisas i lungmaterial så länge patienterna har akuta luftvägssymtom, och en överdriven immunreaktion tycks vara en del av patogenesen. Faktorer hos virus kan bidra till felreglering av immunsvaret, och intensiv forskning för att identifiera sådan virala patogenicitetsfaktorer pågår.
Symtom och klinisk bild
SARS har definierats av WHO, och är anmälningspliktig sjukdom i Sverige. Falldefinitionen enligt smittskyddslagen lyder:
- En klinisk bild med hastigt påkommande hög feber, ofta med frysningar och frossa, och vistelse inom tio dagar före insjuknandet i ett av WHO definierat område med aktuell lokal smittspridning av sjukdomen (se Folkhälsomyndighetens hemsida www.folkhalsomyndigheten.se),
eller
- nära kontakt med ett fall av sjukdomen inom tio dagar före insjuknandet.
Kriterier för svår akut respiratorisk sjukdom (SARS) är f.ö. den kliniska bilden med hastigt påkommande hög feber, ofta (i ca 75 procent av fallen) med frysningar och frossa. Luftvägssymtom saknas eller är milda initialt. Ofta tillfrisknar patienten skenbart efter 3-5 dagar, för att efter ytterligare ett par dagar försämras, med lunginflammation och andningsinsufficiens som viktigaste symtom.
Andra symtom som kan ingå är hosta (ca 60 %), muskelvärk (60 %), huvudvärk (20-55 %), snuva (20 %), halsont (20 %), andnöd (20 %) yrsel och diarré i varierande omfattning i olika rapporter. Mortaliteten hos de drygt 8000 konstaterade fallen var under utbrottet 2003 11 %, men stigande mortalitet med stigande ålder.
Epidemiologi
Under våren 2003 genomlevde världen en epidemi av ett nytt och till en början okänt luftvägsvirus, SARS. Totalt rapporterades 8096 fall varav 774 avlidna. De områden som drabbades hårdast var Kina, Hongkong, Toronto i Kanada, Taiwan, Singapore och Vietnam.
SARS blev i maj 2004 klassad som allmänfarlig sjukdom i smittskyddslagen. SARS-liknande virus finns fortfarande bland smådjur i södra Kina, och virus överfördes troligen ett par gånger från djur till människa 2003. Närkontakt med smittade djur är den viktigaste förutsättningen för att en ny epidemi ska uppkomma. De SARS-virus som spreds mellan människor 2003 hade troligen låg smittsamhet, och stor smittdos var en förutsättning för att sjukdomen skulle spridas. Virus verkar huvudsakligen spridas med droppsmitta, men fall av luftsmitta kan ha förekommit. Inkubationstiden är vanligen 2–5 (upp till 10 dagar). Smittsamheten är i normalfallet mycket låg eller ingen under inkubationsfas och tidig sjukdom. De svårast sjuka patienterna som kom till sjukhus utsöndrade mycket virus, och speciellt vårdpersonal och medpatienter blev smittade. Subklinisk infektion verkar vara mycket ovanlig. Vissa infekterade blev under epidemin ”superspridare”. Om detta berodde på att de utsöndrade mycket virus eller ett mer humananpassat virus än andra är inte klarlagt, men man har kunnat följa långa smittkedjor från sådana personer. Efter juli 2003 har fyra små SARS-utbrott konstaterats. Tre av dess har varit laboratoriesmitta. SARS-CoV växer snabbt till mycket höga titrar i apnjureceller, och odling av virus ställer mycket stora krav på biosäkerhet.
Inget enda fall har rapporterats i Sverige.
Prevention
Förebyggande åtgärder är inriktade på att undvika att smitta förs in i landet. Det är också viktigt att upprätthålla beredskap för tidig upptäckt av misstänkta fall och säkert handhavande av patienter och prov.
Provtagning
Lämpliga provtagningsmaterial för mikrobiologiska undersökningar är nasofarynxaspirat för elektronmikroskopi, genamplifikation och cellodling. Feces, BAL-vätska, sputum, ögonsekret, blod och urin går också att analysera, främst med genamplifikation. I sena publikationer har PCR-undersökning av feces visats vara värdefullt även för tidigdiagnostik. Akut och konvalescentserum 1 månad efter insjuknandet skickas för antikroppspåvisning.
Laboratoriediagnostik
Allmänt
Patientmaterial kan ur smittspridningssynpunkt handhas i klass 2 utrymmen, men personalen ska bära skyddskläder och materialet handhas i skyddsbox. Virusodling på material från SARS-misstänkt patient måste utföras i skyddsklass 3+. Den definitiva SARS-diagnosen är en kriteriediagnos, och det finns ingen metod som verifierat närvaro av SARS-CoV hos alla patienter som anmälts ha SARS. För att konfirmera diagnosen behövs flera undersökningsmetoder, och speciellt tidigdiagnostiken är svår. Virus kan finnas i nästan alla kroppsvätskor, men mängden är liten. Antikroppar blir ofta inte detekterbara förrän efter 1-2 veckor, och serologi ger föga hjälp vid tidigdiagnostik. Flera metoder bör användas för diagnostiken. Om en ny epidemi uppkommer och det diagnostiska behovet så stort att flera laboratorier bör utföra diagnostiken är genamplifikation referensmetod. Metodval diskuteras nedan.
Referensmetod
Genamplifikation
Detta är den viktigaste metoden för detektion av SARS-CoV och ett flertal reverse transcription (RT)-PCR-metoder finns publicerade. Dessa inkluderar både kvalitativa metoder med efterföljande agarosgelelektrofores, samt realtids RT-PCR-metoder som möjliggör kvantifiering av antalet genkopior i ett prov. För att kunna påvisa SARS-CoV med RT-PCR i patientmaterial under de första dagarna av infektion krävs en metod med hög känslighet. Med en av de publicerade realtids RT-PCR-metoderna (Poon et al., 2004a) har man med en modifiering av RNA-extraktionsmetoden (Poon et al., 2003) kunnat påvisa SARS-CoV i 80 % av en samling nasofarynxaspirat (n=50) tagna dag 1-3 efter insjuknandet. I den aktuella metoden extraheras RNA från 560 µL provmaterial med QIAamp Viral RNA Mini Kit (Qiagen). Komplementärt cDNA syntetiseras därefter från extraherat RNA med hjälp av random hexamers i en separat RT-reaktion. I den påföljande realtids-PCRen används primers och probe som är riktade mot en del av genomet (ORF 1b-regionen) som kodar för det virala RNA-polymeraset. Med denna metod kan man påvisa 1 genkopia/reaktion, vilket motsvarar 28 genkopior/mL nasofarynxaspirat.
Ovanstående metod har även vidareutvecklats till en enstegs RT-PCR, samt till en duplex enstegs RT-PCR med detektion av 18S ribosomalt RNA som intern kontroll i varje reaktion (Poon et al., 2004b). Med denna metod påvisades SARS-CoV RNA i 96,6 % av nasofarynxaspiraten (n=29) tagna dag 1-3 efter insjuknandet. För prover tagna dag 4-9 efter insjuknandet (n=57) var motsvarande siffra 80,7 %.
Ingen i Sverige har haft tillgång till patientmaterial som möjliggjort klinisk prövning av de ovan beskrivna metoderna, vilka för närvarande sannolikt är de mest optimala. WHO rekommenderar genamplifikation för SARS-diagnostik. Man rekommenderar inte någon speciell metod, men anser att man bör vidta följande försiktighetsåtgärder: Positiv kontroll, negativ kontroll, gränsvärdeskontroll och inhibitionskontroll ska finnas med i varje test. Minst två olika genamplifieringsmetoder ska vara positiva för säker diagnos, och resultatet bör konfirmeras vid något av WHOs referenslaboratorier. WHO tillhandahåller kontrollsera för de laboratorier som så önskar. En europeisk kvalitetsäkringspanel har skickats avseende SARS-CoV.
Övrig diagnostik
a) Elektronmikroskopi
EM var en viktig metod för identifikation av SARS-CoV, och material från misstänkta SARS-patienter undersöks vid Folkhälsomyndigheten med EM för snabbdiagnostik. Eftersom många förkylningar orsakas av andra coronavirus måste ett fynd av coronavirus alltid verifieras och virus typas.
b) Virusodling
Virus växer bäst på VeroE6 (en apnjurecell). Om ingen cytopatogen effekt uppkommer besvaras odlingen negativ efter 10 dagar.
c) Serologi.
Man har huvudsakligen påvisat IgG antikroppar med serologi, och undersökningar avseende IgM har inte rapporterats ge tidigare diagnos. Såväl ELISA som IF-teknik finns tillgängliga, och det finns även kommersiella ELISA-Kit. Samtiga metoder är relativt dåligt utvärderade, delvis beroende på bristen på serummaterial. Vid Folkhälsomyndigheten används IF-teknik med SARS-CoV-infekterade Vero-celler som antigen. De fem positiva sera som vi hittills fått tillgång till har alla varit positiva med höga titrar.
97 % av SARS-infekterade personer har visats ha antikroppar mätbara med IF-teknik 4 veckor efter insjuknandet. I en ELISA-studie var medeltid innan seropositivitet uppkom 18 dagar, kortaste tiden 5 dagar och den längsta 47 dagar.
Kvalitetssäkring
WHO tillhandahåller referensmaterial för genamplifikation. En Europeisk kvalitetssäkringspanel för genamplifikation har distribuerats från Hamburg.
Svarsrutiner
Text tillkommer
Laboratorierapportering
SARS är en anmälningspliktig sjukdom och klassificeras jämte smittkoppor som samhällsfarlig (Smittskyddslagen 2004:168).
Anmäls enligt gällande falldefinition
Referensfunktioner
Folkhälsomyndigheten. Diagnostik sker i säkerhetslaboratoriet
REFERENSER och hemsidor
- Länk till WHO
- Länk till Folkhälsomyndigheten
- Navas-Martin S. Weiss SR. 2004 Coronavirus replication and pathogenesis: Implications for the recent outbreak of severe acute respiratory syndrome (SARS), and the challenge for vaccine development [Review] Journal of Neurovirology. 10:75-85.
- Barkham TMS. 2004.Laboratory safety aspects of SARS at biosafety level 2 [Review] Annals Academy of Medicine Singapore. 33:252-256.
- Wang JT. Chang SC. 2004. Severe acute respiratory syndrome [Review] Current Opinion in Infectious Diseases. 17:143-148.
- Peiris JSM. Yuen KY. Osterhaus ADME. Stohr K. 2003. Current concepts: The severe acute respiratory syndrome [Review] New England Journal of Medicine. 349:2431-2441.
- Poon, L.L., Chan, K.H., Wong, O.K., Yam, W.C., Yuen, K.Y., Guan, Y., Lo, Y.M. and Peiris, J.S. 2003. Early diagnosis of SARS coronavirus infection by real-time RT-PCR. J Clin Virol 28, 233-8.
- Poon, L.L., Chan, K.H., Wong, O.K., Cheung, T.K., Ng, I., Zheng, B., Seto, W.H., Yuen, K.Y., Guan, Y. and Peiris, J.S. 2004a. Detection of SARS coronavirus in patients with severe acute respiratory syndrome by conventional and real-time quantitative reverse transcription-PCR assays. Clin Chem 50, 67-72.
- Poon, L.L., Wong, B.W., Chan, K.H., Leung, C.S., Yuen, K.Y., Guan, Y. and Peiris, J.S. 2004b. A one step quantitative RT-PCR for detection of SARS coronavirus with an internal control for PCR inhibitors. J Clin Virol 30, 214-7.
- van der Hoek L. Pyrc K. Jebbink MF. Vermeulen-Oost W. Berkhout RJM. Wolthers KC. Wertheim-van Dillen PME. Kaandorp J. Spaargaren J. Berkhout B. 2004. Identification of a new human coronavirus. Nature Medicine. 10(4):368-373.