Skillnad mellan versioner av "Influensa A, B"
| Rad 1: | Rad 1: | ||
| + | '''Huvudartikel''' | ||
| + | |||
| + | ---- | ||
| + | |||
Till innehållsförteckningen för ''[[Referensmetodik: Nedre luftvägsinfektioner, 2:a upplagan 2005]]'' | Till innehållsförteckningen för ''[[Referensmetodik: Nedre luftvägsinfektioner, 2:a upplagan 2005]]'' | ||
---- | ---- | ||
| − | + | [[Fil:luft-figur11.jpg|thumb|left|550px|]] | |
== Influensa A, B == | == Influensa A, B == | ||
| − | |||
| Rad 12: | Rad 15: | ||
Influensavirus tillhör gruppen ortomyxovirus. De är höljeförsedda virus som infekterar luftvägarna. | Influensavirus tillhör gruppen ortomyxovirus. De är höljeförsedda virus som infekterar luftvägarna. | ||
| − | + | Den genetiska informationen består av enkelstängad ribonukleinsyra (RNA) med negativ polaritet. Det finns 3 typer av influensavirus, A, B och C (tabell 15). Andfåglar är influensavirus ursprungliga värdar. Hos dem infekteras tarmen, men de blir nästan aldrig sjuka av influensa. De bär på många olika subtyper av influensa A, men bara ett fåtal har givit epidemier hos människa. Två H-subtyper, H5 och H7, kan bli högpatogena om de smittar från andfågel till hönsfåglar. Fall av svår lunginflammation orsakade av influensa A/H5 har under 1997 och 2003-2005 rapporterats från Sydostasien. | |
| − | + | ||
| + | Influensa innehåller 8 separata gensegment som kodar för 10-11 proteiner. Ett par av de interna proteinerna är unika för respektive typ av influensa. Influensavirus bär på sin yta två utskott, hemagglutinin (H eller HA) och neuraminidas (N eller NA). Det finns 16 olika H och 9 olika N i influensavirus från fåglar. Kombinationen av H och N bestämmer subtypen av influensa A (tabell 15). H binder virus till receptorn på cellytan. Om vi har antikroppar mot ett visst H är vi skyddade mot alla virus som bär just detta H. | ||
| + | Alla influensastammar som karakteriserats inom ramen för WHO:s influensaövervakning namnges. Principen för hur detta sker framgår av tabell 16. Det virus som beskrivs är alltså det 10:e influensa A-viruset som isolerats från människa i Moskva 1999. De virus som är identiska med detta virus på sin yta beskrivs som ”A/Moskva/10/99-lika”. | ||
| + | [[Fil:luft-tabell15.jpg|thumb|left|650px|]] | ||
| + | [[Fil:luft-tabell16.jpg|thumb|left|650px|]] | ||
| − | |||
| + | === Patogenes och patofysiologi === | ||
| − | + | Trots att influensavirus hittas nästan uteslutande i luftvägarna är allmänsymtomen dominerande. Immunologiska signalsubstanser som induceras av infektionen och sprids i hela kroppen är sannolikt orsaken. Mängden signalsubstanser som bildas är relaterad till den mängd influensavirus som produceras. Ju mera virus som bildas desto sjukare blir man. | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| + | === Symtom och klinisk bild === | ||
| + | Influensa A och B ger karakteristisk influensasjukdom (tabell 17). Det vanligaste symtomet är torrhosta. Det som mest skiljer influensa från andra virala luftvägsinfektioner är det plötsliga insjuknandet, muskelvärken och den påtagliga allmänpåverkan. Hos personer med partiell immunitet kan man få alla grader av sjukdom, och en övergående influensareplikation i luftvägarna kan vara totalt symtomlös eller ge endast lätt snuva. | ||
| + | [[Fil:luft-tabell17.jpg|thumb|left|650px|]] | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | + | === Epidemiologi === | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| + | Influensavirus sprids mycket effektivt. Det smittar dels genom aerosol, och kan sväva länge i luften på mycket små (10µ) partiklar, dels via kontaminerade fingrar. En tumregel är att ju sjukare man är, desto mera virus utsöndras och desto mer smittar man. Influensa sprids under respektive vinter¬säsong på norra och södra halvklotet. Anledningen till årstidsvariationerna är oklar, men att många personer vistas länge i samma rum på skolor och arbetsplatser bidrar till spridningen. | ||
| − | |||
| − | |||
Vi kan sjukna i influensa betydligt oftare än man skulle kunna tro med tanke på det begränsade antalet typer och subtyper. Detta beror på att influensavirus kan förändra sin yta och bli oigenkännligt för immunsystemet på många sätt (Tabell 18). | Vi kan sjukna i influensa betydligt oftare än man skulle kunna tro med tanke på det begränsade antalet typer och subtyper. Detta beror på att influensavirus kan förändra sin yta och bli oigenkännligt för immunsystemet på många sätt (Tabell 18). | ||
| − | Profylax och behandling | + | |
| + | === Profylax och behandling === | ||
| + | |||
Om skydd mot influensa behövs är vaccin förstahandsprofylax, men vid institutionsutbrott som berör personer med risk för svår influensasjukdom kan profylaktisk behandling övervägas. Andra överväganden kan komma att behövas om effektivt vaccin saknas. | Om skydd mot influensa behövs är vaccin förstahandsprofylax, men vid institutionsutbrott som berör personer med risk för svår influensasjukdom kan profylaktisk behandling övervägas. Andra överväganden kan komma att behövas om effektivt vaccin saknas. | ||
| + | |||
Influensavaccin framställs genom att de influensastammar som väntas för året renas fram från chorio-allantoisvätskan i infekterade hönsägg. Vid WHO beslutas i februari vilka stammar som ska ingå det vaccin som ska användas på hösten på norra halvklotet och i september för det som ska användas under hösten på södra halvklotet. | Influensavaccin framställs genom att de influensastammar som väntas för året renas fram från chorio-allantoisvätskan i infekterade hönsägg. Vid WHO beslutas i februari vilka stammar som ska ingå det vaccin som ska användas på hösten på norra halvklotet och i september för det som ska användas under hösten på södra halvklotet. | ||
| + | [[Fil:luft-tabell18.jpg|thumb|left|650px|]] | ||
| + | |||
| + | |||
| + | Vaccinets skyddseffekt varar ca 9 månader. Den som bör/vill ha skydd mot influensa måste alltså vaccineras årligen, oavsett om en ny stam dykt upp eller inte. Neuramidashämmare är antivirala substanser som förhindrar virus spridning från cell till cell. Två neuraminidashämmare finns registrerade, Zanamivir (Relenza®) och Oseltamivir (Tamiflu®). Det svenska Läkemedelsverket och Referensgruppen för Antiviral terapi (RAV) rekommenderar att man överväger behandling med neuraminidashämmare endast vid svår influensasjukdom, och förutsatt att influensaförekomst verifierats i samhället eller hos patienten. Endast Oseltamivir är registrerat för profylax. Skyddseffekten är ca 90 % vid medicinering under 7 dagar, när preparatet insatts inom 48 timmar efter exposition eller vid långtidsbehandling under 6 veckor mot samhällsförvärvad influensa. | ||
| − | + | === Laboratoriediagnostik === | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| + | ==== Allmänt ==== | ||
| − | |||
| − | |||
| − | |||
De viktigaste metoderna för influensadiagnostik är agenspåvisning genom antigendetektion, odling eller genamplifikation. IgM-svaret vid influensainfektion är varierande, och analys av specifikt IgM har låg diagnostisk signifikans. | De viktigaste metoderna för influensadiagnostik är agenspåvisning genom antigendetektion, odling eller genamplifikation. IgM-svaret vid influensainfektion är varierande, och analys av specifikt IgM har låg diagnostisk signifikans. | ||
Referensmetodik | Referensmetodik | ||
| − | Virusodling | + | |
| + | ==== Virusodling ==== | ||
| + | |||
Influensavirus odlas vid de flesta laboratorier i en cellinje från hundnjure, Madin-Darby Canine Kidney (MDCK)-celler. Olika typer av patientmaterial från luftvägarna kan användas. Odling är ofta ett komplement till antigendetektion, och i Sverige används numera nasofarynxaspirat för båda undersökningarna. Virus finns i svalg och näsa, och utomlands används ofta material från svalgpinne eller näsprov i virusmedium för virusodling. Virusodling anses fortfarande vara referensmetod för detektion, och vid optimal metodik är den sannolikt nästan lika känslig som PCR. Som alla isoleringsmetoder kräver den extremt noggrann kvalitetskontroll, inte minst monitorering av cellernas känslighet. I samband med provsättning krävs också byte till cellmedium med tryspin för att klyva H. Om inte detta sker kan inte virusgenomet frigöras i cellen. Trypsin av hög kvalitet kan ibland vara svårt att få tag på. | Influensavirus odlas vid de flesta laboratorier i en cellinje från hundnjure, Madin-Darby Canine Kidney (MDCK)-celler. Olika typer av patientmaterial från luftvägarna kan användas. Odling är ofta ett komplement till antigendetektion, och i Sverige används numera nasofarynxaspirat för båda undersökningarna. Virus finns i svalg och näsa, och utomlands används ofta material från svalgpinne eller näsprov i virusmedium för virusodling. Virusodling anses fortfarande vara referensmetod för detektion, och vid optimal metodik är den sannolikt nästan lika känslig som PCR. Som alla isoleringsmetoder kräver den extremt noggrann kvalitetskontroll, inte minst monitorering av cellernas känslighet. I samband med provsättning krävs också byte till cellmedium med tryspin för att klyva H. Om inte detta sker kan inte virusgenomet frigöras i cellen. Trypsin av hög kvalitet kan ibland vara svårt att få tag på. | ||
| − | Alternativ diagnostik | + | |
| − | a) Antigendetektion | + | ==== Alternativ diagnostik ==== |
| + | |||
| + | |||
| + | ==== a) Antigendetektion ==== | ||
| + | |||
I Sverige används vid de flesta laboratorier IF på cellpreparat från nasofarynx-aspirat eller nasofarynxpinne för antigendetektion. Kommersiella antikroppar används, och såväl direktmärkta som omärkta monoklonala antikroppar finns att tillgå. Testets känslighet jämfört med virusodling ligger på mellan 60 och 90 %, i medeltal sannolikt ca 80 %. Utstryk från pinne ger något lägre känslighet än utstryk av nasofarynxaspirat, men den exakta skillnaden är inte undersökt – få patienter går med på två nasofarynxprovtagningar! Specificiteten brukar vara ca 95 %. Testerna är ofta något sämre för influensa B än influensa A. Direktmärkta antikroppar ger något lägre känslighet än indirekta tester, men dessa tar kortare tid och kan ge mer ospecifik bakgrund. | I Sverige används vid de flesta laboratorier IF på cellpreparat från nasofarynx-aspirat eller nasofarynxpinne för antigendetektion. Kommersiella antikroppar används, och såväl direktmärkta som omärkta monoklonala antikroppar finns att tillgå. Testets känslighet jämfört med virusodling ligger på mellan 60 och 90 %, i medeltal sannolikt ca 80 %. Utstryk från pinne ger något lägre känslighet än utstryk av nasofarynxaspirat, men den exakta skillnaden är inte undersökt – få patienter går med på två nasofarynxprovtagningar! Specificiteten brukar vara ca 95 %. Testerna är ofta något sämre för influensa B än influensa A. Direktmärkta antikroppar ger något lägre känslighet än indirekta tester, men dessa tar kortare tid och kan ge mer ospecifik bakgrund. | ||
| + | |||
Det finns ett flertal kommersiella tester för antigendetektion baserade på EIA-teknik avsedda för såväl laborartoriebruk som patientnära analys. De i Sverige före¬kommande bygger på antigen/antikroppsreaktioner. De flesta kommersiella testerna innehåller antikroppar som riktas mot nukleokapsiden, och är typspecifika för influensa A eller B. Några påvisar både influensa A och B. En del är jämförbara med IF avseende specificitet och sensitivitet när de används vid laboratorier. Prövningar av testen i stor skala med patientnära analyser har inte gjorts i Sverige, men enligt rapporter från andra länder blir resultaten sämre när testerna utförs av personer utan laboratorievana. | Det finns ett flertal kommersiella tester för antigendetektion baserade på EIA-teknik avsedda för såväl laborartoriebruk som patientnära analys. De i Sverige före¬kommande bygger på antigen/antikroppsreaktioner. De flesta kommersiella testerna innehåller antikroppar som riktas mot nukleokapsiden, och är typspecifika för influensa A eller B. Några påvisar både influensa A och B. En del är jämförbara med IF avseende specificitet och sensitivitet när de används vid laboratorier. Prövningar av testen i stor skala med patientnära analyser har inte gjorts i Sverige, men enligt rapporter från andra länder blir resultaten sämre när testerna utförs av personer utan laboratorievana. | ||
| − | b) Nukleinsyrapåvisning | + | |
| + | ==== b) Nukleinsyrapåvisning ==== | ||
| + | |||
Såväl ute i världen som i Sverige börjar genomaplifikation, ofta med realtids-teknik, att ersätta andra metoder för influensapåvisning. Matrix-genen och H-genen används ofta som målgener för primers. Cybr-green för detektion ger en relativt god känslighet, och gör testet mera okänsligt för sekvensvariationer än en specifik probe. Nestade test bör användas om detektion sker i gel. Känsligheten hos PCR vid undersökning av kliniska material har varierat i olika rapporter, men är mellan 90-150 % av känsligheten vid virusisolering. Skillnaderna i känslighet kan bero på PCR-teknikerna, men kvaliteten på referensmetoden spelar också stor roll. Kommersiella tester finns, men används ännu inte i någon stor omfattning. En del är multiplexa, med reagenser för många luftvägsvirus. Ännu finns inte någon storskalig utvärdering som tillåter presentation av en referensmetod för genom-amplifikation avseende influensa. | Såväl ute i världen som i Sverige börjar genomaplifikation, ofta med realtids-teknik, att ersätta andra metoder för influensapåvisning. Matrix-genen och H-genen används ofta som målgener för primers. Cybr-green för detektion ger en relativt god känslighet, och gör testet mera okänsligt för sekvensvariationer än en specifik probe. Nestade test bör användas om detektion sker i gel. Känsligheten hos PCR vid undersökning av kliniska material har varierat i olika rapporter, men är mellan 90-150 % av känsligheten vid virusisolering. Skillnaderna i känslighet kan bero på PCR-teknikerna, men kvaliteten på referensmetoden spelar också stor roll. Kommersiella tester finns, men används ännu inte i någon stor omfattning. En del är multiplexa, med reagenser för många luftvägsvirus. Ännu finns inte någon storskalig utvärdering som tillåter presentation av en referensmetod för genom-amplifikation avseende influensa. | ||
| − | c) Serologi | + | |
| + | |||
| + | ==== c) Serologi ==== | ||
| + | |||
IgM-serologi är opålitlig, och diagnostik bygger på titerstegring mellan akut och konvalescentprov. Många metoder används, men ingen är optimal. Hemagglutninations-inhibitionstest (HAI; se nedan) får anses som referensmetod, och har vid stora studier en känslighet på ca 80 % jämfört med virusisolering. HI kan skilja mellan antikroppar mot olika subtyper av influensa A. ELISA-metoder bygger ofta på cellodlat, renat influensavirus, och innehåller ofta även kontroll-antigen. De är typspecifika men inte subtypspecifika. Känsligheten är jämförbar med HI. Komplementbindning för influensaantikroppar används fortfarande, men har inga fördelar jämföret med ELISA. Serologi avseende influensa är relativt okänslig och sällan informativ under akutskedet, då behandling är möjlig. Därför bör man sträva efter att lämpligt prov tas för viruspåvisning när patienten är sjuk, även om serologiskt prov tas. | IgM-serologi är opålitlig, och diagnostik bygger på titerstegring mellan akut och konvalescentprov. Många metoder används, men ingen är optimal. Hemagglutninations-inhibitionstest (HAI; se nedan) får anses som referensmetod, och har vid stora studier en känslighet på ca 80 % jämfört med virusisolering. HI kan skilja mellan antikroppar mot olika subtyper av influensa A. ELISA-metoder bygger ofta på cellodlat, renat influensavirus, och innehåller ofta även kontroll-antigen. De är typspecifika men inte subtypspecifika. Känsligheten är jämförbar med HI. Komplementbindning för influensaantikroppar används fortfarande, men har inga fördelar jämföret med ELISA. Serologi avseende influensa är relativt okänslig och sällan informativ under akutskedet, då behandling är möjlig. Därför bör man sträva efter att lämpligt prov tas för viruspåvisning när patienten är sjuk, även om serologiskt prov tas. | ||
| − | Stamkarakterisering | + | |
| − | För att ta reda på om det uppstått ett nytt virus, eller om virus förändrats så att ett vaccin blivit ineffektivt, använder man fortfarande mycket traditionella, serologiska tester. Man immuniserar ett djur, numera mest iller, med ett influensavirus. Serum från dessa innehåller antikroppar som bara reagerar med H som mycket liknar H på det virus man immuniserat med. H från influensa klumpar ihop, agglutinerar, röda blodkroppar från exempelvis kycklingar. Om det finns skyddande antikroppar förhindrar dessa att blodkropparna klumpas ihop. Detta kallas hemagglutinations¬inhibition (HAI). HAI är fortfarande den vanligaste metoden för att undersöka släktskap mellan olika influensastammar, och om personer har skyddande antikroppar mot en viss influensastam. Fullständig karakterisering med HAI kräver tillgång till en stor mängd olika illersera, och sker vid WHO:s referenslaboratorier. | + | === Stamkarakterisering === |
| + | |||
| + | För att ta reda på om det uppstått ett nytt virus, eller om virus förändrats så att ett vaccin blivit ineffektivt, använder man fortfarande mycket traditionella, serologiska tester. Man immuniserar ett djur, numera mest iller, med ett influensavirus. Serum från dessa innehåller antikroppar som bara reagerar med H som mycket liknar H på det virus man immuniserat med. H från influensa klumpar ihop, agglutinerar, röda blodkroppar från exempelvis kycklingar. Om det finns skyddande antikroppar förhindrar dessa att blodkropparna klumpas ihop. Detta kallas hemagglutinations¬inhibition (HAI). HAI är fortfarande den vanligaste metoden för att undersöka släktskap mellan olika influensastammar, och om personer har skyddande antikroppar mot en viss influensastam. Fullständig karakterisering med HAI kräver tillgång till en stor mängd olika illersera, och sker vid WHO:s referenslaboratorier. | ||
| + | |||
Begränsad typning och genetisk analys sker vid nationella influensacentra. Vid sex laboratorier i Sverige isoleras influensa. Dessa laboratorier skickar influensastammar till SMI för fortsatt karakterisering. Ca 40 stammar/år brukar analyseras, med fokus på isolat som gjorts mycket tidigt och mycket sent under säsongen. Vid SMI görs så snart som möjligt analys av subtyp och karakterisering av HA med illersera som är representativa för säsongen. H och N sekvenseras, och dessa genanalyser sammanställs i fylogenetiska träd. Vid ett par tillfälles skickas isolat till WHO:s regionala influensalaboratorium i Europa vid Mill Hill i London, där HAI mot ett flertal serum görs. Om något isolat verkar avvika från de för säsongen förekommande vid den screeningsundersökning som görs vid SMI skickas det omgående till England. Sedan de nya antivirala medlen kom bör bedömning avseende resistens mot dessa göras fortlöpande. Detta görs dels genom NA-sekvenseringen, då vissa resistensmutationer för NA är kända. För somliga isolat görs också konventionell resistensbestämning mot Zanamivir och Oseltamivir. | Begränsad typning och genetisk analys sker vid nationella influensacentra. Vid sex laboratorier i Sverige isoleras influensa. Dessa laboratorier skickar influensastammar till SMI för fortsatt karakterisering. Ca 40 stammar/år brukar analyseras, med fokus på isolat som gjorts mycket tidigt och mycket sent under säsongen. Vid SMI görs så snart som möjligt analys av subtyp och karakterisering av HA med illersera som är representativa för säsongen. H och N sekvenseras, och dessa genanalyser sammanställs i fylogenetiska träd. Vid ett par tillfälles skickas isolat till WHO:s regionala influensalaboratorium i Europa vid Mill Hill i London, där HAI mot ett flertal serum görs. Om något isolat verkar avvika från de för säsongen förekommande vid den screeningsundersökning som görs vid SMI skickas det omgående till England. Sedan de nya antivirala medlen kom bör bedömning avseende resistens mot dessa göras fortlöpande. Detta görs dels genom NA-sekvenseringen, då vissa resistensmutationer för NA är kända. För somliga isolat görs också konventionell resistensbestämning mot Zanamivir och Oseltamivir. | ||
| − | Resistensbestämning och resistensutveckling | + | |
| + | === Resistensbestämning och resistensutveckling === | ||
| + | |||
Sedan de nya antivirala medlen kom bör bedömning avseende resistens mot dessa göras fortlöpande. Detta görs genom NA-sekvenseringen, då vissa resistensmutationer för NA är kända. För somliga isolat görs också fenotypisk resistensbestämning mot zanamivir och oseltamivir. | Sedan de nya antivirala medlen kom bör bedömning avseende resistens mot dessa göras fortlöpande. Detta görs genom NA-sekvenseringen, då vissa resistensmutationer för NA är kända. För somliga isolat görs också fenotypisk resistensbestämning mot zanamivir och oseltamivir. | ||
| − | Kvalitetskontroll | + | |
| + | === Kvalitetskontroll === | ||
| + | |||
EQUALIS tillhandahåller paneler för virusodling, antigendetektion och genamplifikation. UKNEQAS har en luftvägspanel för virusodling, i vilken influensa kan ingå. Europeiska nationella influensacentra deltar i kontroll av virusodling genom EISS (Europena Influenza Surveillance System). | EQUALIS tillhandahåller paneler för virusodling, antigendetektion och genamplifikation. UKNEQAS har en luftvägspanel för virusodling, i vilken influensa kan ingå. Europeiska nationella influensacentra deltar i kontroll av virusodling genom EISS (Europena Influenza Surveillance System). | ||
| − | Misstänkt aviär influensa eller ny influensastam. | + | |
| + | == Misstänkt aviär influensa eller ny influensastam. == | ||
| + | |||
Om en patient misstänks vara smittad med en influensastam som inte tidigare förekommit i samhället bör prov skickas direkt till SMI för analys. Vid SMI görs virusisolering i P3+ eller P4 beroende på patogenicitetsgrad hos misstänkt virus. RNA extraheras, och PCR mot kända, humaninfekterande influensa typer- och subtyper görs. Om test med generella primers för matrix är positivt, men PCR för H negativt görs subtypning genom direktsekvensering eller genom sekvensering av odlat material. Vid förändringar i influensaepidemiologin, som kan innebära pandemihot sker regelbunden uppdatering av instruktioner avseende provtagning etc. på SMIs hemsida. | Om en patient misstänks vara smittad med en influensastam som inte tidigare förekommit i samhället bör prov skickas direkt till SMI för analys. Vid SMI görs virusisolering i P3+ eller P4 beroende på patogenicitetsgrad hos misstänkt virus. RNA extraheras, och PCR mot kända, humaninfekterande influensa typer- och subtyper görs. Om test med generella primers för matrix är positivt, men PCR för H negativt görs subtypning genom direktsekvensering eller genom sekvensering av odlat material. Vid förändringar i influensaepidemiologin, som kan innebära pandemihot sker regelbunden uppdatering av instruktioner avseende provtagning etc. på SMIs hemsida. | ||
| − | Svarsrutin inklusive referensförfarande | + | |
| + | == Svarsrutin inklusive referensförfarande == | ||
| + | |||
När influensavirus isolerats, verifierats och om indicerat, typats, svaras: Influensa, typ, eventuell subtyp påvisat vid odling i vävnadskultur, och typning med (använd metod). Om vidare undersökning är indicerad skickas material vidare till WHO’s referenslaboratorium i Mill Hill i England. | När influensavirus isolerats, verifierats och om indicerat, typats, svaras: Influensa, typ, eventuell subtyp påvisat vid odling i vävnadskultur, och typning med (använd metod). Om vidare undersökning är indicerad skickas material vidare till WHO’s referenslaboratorium i Mill Hill i England. | ||
| − | Laboratorierapportering | + | |
| + | == Laboratorierapportering == | ||
| + | |||
Influensa är inte en anmälningspliktig sjukdom. | Influensa är inte en anmälningspliktig sjukdom. | ||
| + | |||
Hösten 1993 initierades dock ett system där alla laboratorier som bedriver influensadiagnostik veckovis till SMI rapporterar antal influensadiagnoser, samt patienternas kön och ålder. Systemet har fungerat mycket bra, och under epidemiår har mer än 2 diagnoser/105 invånare rapporterats, vilket internationellt sett sannolikt är mycket. Laboratorierapporterna och rapporter om klinisk influensa från utvalda läkare över hela Sverige sammanställs varje vecka på SMIs hemsida. | Hösten 1993 initierades dock ett system där alla laboratorier som bedriver influensadiagnostik veckovis till SMI rapporterar antal influensadiagnoser, samt patienternas kön och ålder. Systemet har fungerat mycket bra, och under epidemiår har mer än 2 diagnoser/105 invånare rapporterats, vilket internationellt sett sannolikt är mycket. Laboratorierapporterna och rapporter om klinisk influensa från utvalda läkare över hela Sverige sammanställs varje vecka på SMIs hemsida. | ||
| − | REFERENSER | + | |
| + | == REFERENSER == | ||
| + | |||
Diagnostic Procedures for Viral, Rikettsial, and Chlamydial Infektions. 7th Edition. Edwin H. Lennette PhD, David A. Lennette PhD, Evelyne T. Lennette PhD. | Diagnostic Procedures for Viral, Rikettsial, and Chlamydial Infektions. 7th Edition. Edwin H. Lennette PhD, David A. Lennette PhD, Evelyne T. Lennette PhD. | ||
| + | |||
Textbook of influenza; Blackwell science, ltd, Oxford 1998, Nicholson K, Webster J and Hay A. | Textbook of influenza; Blackwell science, ltd, Oxford 1998, Nicholson K, Webster J and Hay A. | ||
| + | |||
| + | [[Kategori:Nedre luftvägsinfektioner]] | ||
Versionen från 3 augusti 2009 kl. 14.06
Huvudartikel
Till innehållsförteckningen för Referensmetodik: Nedre luftvägsinfektioner, 2:a upplagan 2005
Influensa A, B
Smittämnen
Influensavirus tillhör gruppen ortomyxovirus. De är höljeförsedda virus som infekterar luftvägarna.
Den genetiska informationen består av enkelstängad ribonukleinsyra (RNA) med negativ polaritet. Det finns 3 typer av influensavirus, A, B och C (tabell 15). Andfåglar är influensavirus ursprungliga värdar. Hos dem infekteras tarmen, men de blir nästan aldrig sjuka av influensa. De bär på många olika subtyper av influensa A, men bara ett fåtal har givit epidemier hos människa. Två H-subtyper, H5 och H7, kan bli högpatogena om de smittar från andfågel till hönsfåglar. Fall av svår lunginflammation orsakade av influensa A/H5 har under 1997 och 2003-2005 rapporterats från Sydostasien.
Influensa innehåller 8 separata gensegment som kodar för 10-11 proteiner. Ett par av de interna proteinerna är unika för respektive typ av influensa. Influensavirus bär på sin yta två utskott, hemagglutinin (H eller HA) och neuraminidas (N eller NA). Det finns 16 olika H och 9 olika N i influensavirus från fåglar. Kombinationen av H och N bestämmer subtypen av influensa A (tabell 15). H binder virus till receptorn på cellytan. Om vi har antikroppar mot ett visst H är vi skyddade mot alla virus som bär just detta H.
Alla influensastammar som karakteriserats inom ramen för WHO:s influensaövervakning namnges. Principen för hur detta sker framgår av tabell 16. Det virus som beskrivs är alltså det 10:e influensa A-viruset som isolerats från människa i Moskva 1999. De virus som är identiska med detta virus på sin yta beskrivs som ”A/Moskva/10/99-lika”.
Patogenes och patofysiologi
Trots att influensavirus hittas nästan uteslutande i luftvägarna är allmänsymtomen dominerande. Immunologiska signalsubstanser som induceras av infektionen och sprids i hela kroppen är sannolikt orsaken. Mängden signalsubstanser som bildas är relaterad till den mängd influensavirus som produceras. Ju mera virus som bildas desto sjukare blir man.
Symtom och klinisk bild
Influensa A och B ger karakteristisk influensasjukdom (tabell 17). Det vanligaste symtomet är torrhosta. Det som mest skiljer influensa från andra virala luftvägsinfektioner är det plötsliga insjuknandet, muskelvärken och den påtagliga allmänpåverkan. Hos personer med partiell immunitet kan man få alla grader av sjukdom, och en övergående influensareplikation i luftvägarna kan vara totalt symtomlös eller ge endast lätt snuva.
Epidemiologi
Influensavirus sprids mycket effektivt. Det smittar dels genom aerosol, och kan sväva länge i luften på mycket små (10µ) partiklar, dels via kontaminerade fingrar. En tumregel är att ju sjukare man är, desto mera virus utsöndras och desto mer smittar man. Influensa sprids under respektive vinter¬säsong på norra och södra halvklotet. Anledningen till årstidsvariationerna är oklar, men att många personer vistas länge i samma rum på skolor och arbetsplatser bidrar till spridningen.
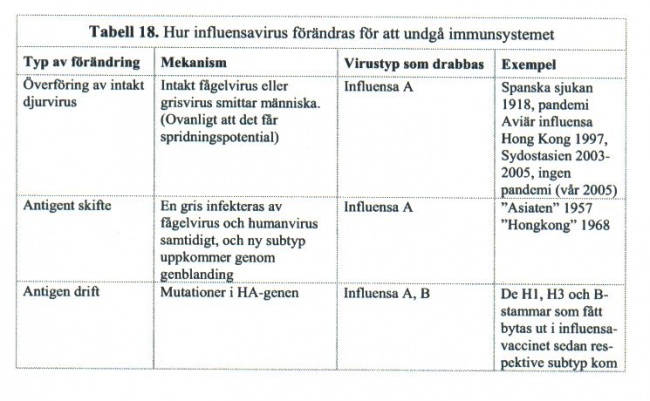
Vi kan sjukna i influensa betydligt oftare än man skulle kunna tro med tanke på det begränsade antalet typer och subtyper. Detta beror på att influensavirus kan förändra sin yta och bli oigenkännligt för immunsystemet på många sätt (Tabell 18).
Profylax och behandling
Om skydd mot influensa behövs är vaccin förstahandsprofylax, men vid institutionsutbrott som berör personer med risk för svår influensasjukdom kan profylaktisk behandling övervägas. Andra överväganden kan komma att behövas om effektivt vaccin saknas.
Influensavaccin framställs genom att de influensastammar som väntas för året renas fram från chorio-allantoisvätskan i infekterade hönsägg. Vid WHO beslutas i februari vilka stammar som ska ingå det vaccin som ska användas på hösten på norra halvklotet och i september för det som ska användas under hösten på södra halvklotet.
Vaccinets skyddseffekt varar ca 9 månader. Den som bör/vill ha skydd mot influensa måste alltså vaccineras årligen, oavsett om en ny stam dykt upp eller inte. Neuramidashämmare är antivirala substanser som förhindrar virus spridning från cell till cell. Två neuraminidashämmare finns registrerade, Zanamivir (Relenza®) och Oseltamivir (Tamiflu®). Det svenska Läkemedelsverket och Referensgruppen för Antiviral terapi (RAV) rekommenderar att man överväger behandling med neuraminidashämmare endast vid svår influensasjukdom, och förutsatt att influensaförekomst verifierats i samhället eller hos patienten. Endast Oseltamivir är registrerat för profylax. Skyddseffekten är ca 90 % vid medicinering under 7 dagar, när preparatet insatts inom 48 timmar efter exposition eller vid långtidsbehandling under 6 veckor mot samhällsförvärvad influensa.
Laboratoriediagnostik
Allmänt
De viktigaste metoderna för influensadiagnostik är agenspåvisning genom antigendetektion, odling eller genamplifikation. IgM-svaret vid influensainfektion är varierande, och analys av specifikt IgM har låg diagnostisk signifikans. Referensmetodik
Virusodling
Influensavirus odlas vid de flesta laboratorier i en cellinje från hundnjure, Madin-Darby Canine Kidney (MDCK)-celler. Olika typer av patientmaterial från luftvägarna kan användas. Odling är ofta ett komplement till antigendetektion, och i Sverige används numera nasofarynxaspirat för båda undersökningarna. Virus finns i svalg och näsa, och utomlands används ofta material från svalgpinne eller näsprov i virusmedium för virusodling. Virusodling anses fortfarande vara referensmetod för detektion, och vid optimal metodik är den sannolikt nästan lika känslig som PCR. Som alla isoleringsmetoder kräver den extremt noggrann kvalitetskontroll, inte minst monitorering av cellernas känslighet. I samband med provsättning krävs också byte till cellmedium med tryspin för att klyva H. Om inte detta sker kan inte virusgenomet frigöras i cellen. Trypsin av hög kvalitet kan ibland vara svårt att få tag på.
Alternativ diagnostik
a) Antigendetektion
I Sverige används vid de flesta laboratorier IF på cellpreparat från nasofarynx-aspirat eller nasofarynxpinne för antigendetektion. Kommersiella antikroppar används, och såväl direktmärkta som omärkta monoklonala antikroppar finns att tillgå. Testets känslighet jämfört med virusodling ligger på mellan 60 och 90 %, i medeltal sannolikt ca 80 %. Utstryk från pinne ger något lägre känslighet än utstryk av nasofarynxaspirat, men den exakta skillnaden är inte undersökt – få patienter går med på två nasofarynxprovtagningar! Specificiteten brukar vara ca 95 %. Testerna är ofta något sämre för influensa B än influensa A. Direktmärkta antikroppar ger något lägre känslighet än indirekta tester, men dessa tar kortare tid och kan ge mer ospecifik bakgrund.
Det finns ett flertal kommersiella tester för antigendetektion baserade på EIA-teknik avsedda för såväl laborartoriebruk som patientnära analys. De i Sverige före¬kommande bygger på antigen/antikroppsreaktioner. De flesta kommersiella testerna innehåller antikroppar som riktas mot nukleokapsiden, och är typspecifika för influensa A eller B. Några påvisar både influensa A och B. En del är jämförbara med IF avseende specificitet och sensitivitet när de används vid laboratorier. Prövningar av testen i stor skala med patientnära analyser har inte gjorts i Sverige, men enligt rapporter från andra länder blir resultaten sämre när testerna utförs av personer utan laboratorievana.
b) Nukleinsyrapåvisning
Såväl ute i världen som i Sverige börjar genomaplifikation, ofta med realtids-teknik, att ersätta andra metoder för influensapåvisning. Matrix-genen och H-genen används ofta som målgener för primers. Cybr-green för detektion ger en relativt god känslighet, och gör testet mera okänsligt för sekvensvariationer än en specifik probe. Nestade test bör användas om detektion sker i gel. Känsligheten hos PCR vid undersökning av kliniska material har varierat i olika rapporter, men är mellan 90-150 % av känsligheten vid virusisolering. Skillnaderna i känslighet kan bero på PCR-teknikerna, men kvaliteten på referensmetoden spelar också stor roll. Kommersiella tester finns, men används ännu inte i någon stor omfattning. En del är multiplexa, med reagenser för många luftvägsvirus. Ännu finns inte någon storskalig utvärdering som tillåter presentation av en referensmetod för genom-amplifikation avseende influensa.
c) Serologi
IgM-serologi är opålitlig, och diagnostik bygger på titerstegring mellan akut och konvalescentprov. Många metoder används, men ingen är optimal. Hemagglutninations-inhibitionstest (HAI; se nedan) får anses som referensmetod, och har vid stora studier en känslighet på ca 80 % jämfört med virusisolering. HI kan skilja mellan antikroppar mot olika subtyper av influensa A. ELISA-metoder bygger ofta på cellodlat, renat influensavirus, och innehåller ofta även kontroll-antigen. De är typspecifika men inte subtypspecifika. Känsligheten är jämförbar med HI. Komplementbindning för influensaantikroppar används fortfarande, men har inga fördelar jämföret med ELISA. Serologi avseende influensa är relativt okänslig och sällan informativ under akutskedet, då behandling är möjlig. Därför bör man sträva efter att lämpligt prov tas för viruspåvisning när patienten är sjuk, även om serologiskt prov tas.
Stamkarakterisering
För att ta reda på om det uppstått ett nytt virus, eller om virus förändrats så att ett vaccin blivit ineffektivt, använder man fortfarande mycket traditionella, serologiska tester. Man immuniserar ett djur, numera mest iller, med ett influensavirus. Serum från dessa innehåller antikroppar som bara reagerar med H som mycket liknar H på det virus man immuniserat med. H från influensa klumpar ihop, agglutinerar, röda blodkroppar från exempelvis kycklingar. Om det finns skyddande antikroppar förhindrar dessa att blodkropparna klumpas ihop. Detta kallas hemagglutinations¬inhibition (HAI). HAI är fortfarande den vanligaste metoden för att undersöka släktskap mellan olika influensastammar, och om personer har skyddande antikroppar mot en viss influensastam. Fullständig karakterisering med HAI kräver tillgång till en stor mängd olika illersera, och sker vid WHO:s referenslaboratorier.
Begränsad typning och genetisk analys sker vid nationella influensacentra. Vid sex laboratorier i Sverige isoleras influensa. Dessa laboratorier skickar influensastammar till SMI för fortsatt karakterisering. Ca 40 stammar/år brukar analyseras, med fokus på isolat som gjorts mycket tidigt och mycket sent under säsongen. Vid SMI görs så snart som möjligt analys av subtyp och karakterisering av HA med illersera som är representativa för säsongen. H och N sekvenseras, och dessa genanalyser sammanställs i fylogenetiska träd. Vid ett par tillfälles skickas isolat till WHO:s regionala influensalaboratorium i Europa vid Mill Hill i London, där HAI mot ett flertal serum görs. Om något isolat verkar avvika från de för säsongen förekommande vid den screeningsundersökning som görs vid SMI skickas det omgående till England. Sedan de nya antivirala medlen kom bör bedömning avseende resistens mot dessa göras fortlöpande. Detta görs dels genom NA-sekvenseringen, då vissa resistensmutationer för NA är kända. För somliga isolat görs också konventionell resistensbestämning mot Zanamivir och Oseltamivir.
Resistensbestämning och resistensutveckling
Sedan de nya antivirala medlen kom bör bedömning avseende resistens mot dessa göras fortlöpande. Detta görs genom NA-sekvenseringen, då vissa resistensmutationer för NA är kända. För somliga isolat görs också fenotypisk resistensbestämning mot zanamivir och oseltamivir.
Kvalitetskontroll
EQUALIS tillhandahåller paneler för virusodling, antigendetektion och genamplifikation. UKNEQAS har en luftvägspanel för virusodling, i vilken influensa kan ingå. Europeiska nationella influensacentra deltar i kontroll av virusodling genom EISS (Europena Influenza Surveillance System).
Misstänkt aviär influensa eller ny influensastam.
Om en patient misstänks vara smittad med en influensastam som inte tidigare förekommit i samhället bör prov skickas direkt till SMI för analys. Vid SMI görs virusisolering i P3+ eller P4 beroende på patogenicitetsgrad hos misstänkt virus. RNA extraheras, och PCR mot kända, humaninfekterande influensa typer- och subtyper görs. Om test med generella primers för matrix är positivt, men PCR för H negativt görs subtypning genom direktsekvensering eller genom sekvensering av odlat material. Vid förändringar i influensaepidemiologin, som kan innebära pandemihot sker regelbunden uppdatering av instruktioner avseende provtagning etc. på SMIs hemsida.
Svarsrutin inklusive referensförfarande
När influensavirus isolerats, verifierats och om indicerat, typats, svaras: Influensa, typ, eventuell subtyp påvisat vid odling i vävnadskultur, och typning med (använd metod). Om vidare undersökning är indicerad skickas material vidare till WHO’s referenslaboratorium i Mill Hill i England.
Laboratorierapportering
Influensa är inte en anmälningspliktig sjukdom.
Hösten 1993 initierades dock ett system där alla laboratorier som bedriver influensadiagnostik veckovis till SMI rapporterar antal influensadiagnoser, samt patienternas kön och ålder. Systemet har fungerat mycket bra, och under epidemiår har mer än 2 diagnoser/105 invånare rapporterats, vilket internationellt sett sannolikt är mycket. Laboratorierapporterna och rapporter om klinisk influensa från utvalda läkare över hela Sverige sammanställs varje vecka på SMIs hemsida.
REFERENSER
Diagnostic Procedures for Viral, Rikettsial, and Chlamydial Infektions. 7th Edition. Edwin H. Lennette PhD, David A. Lennette PhD, Evelyne T. Lennette PhD.
Textbook of influenza; Blackwell science, ltd, Oxford 1998, Nicholson K, Webster J and Hay A.