Skillnad mellan versioner av "Trypanosoma brucei"
| Rad 36: | Rad 36: | ||
Vid hantering av patientmaterial beaktas skyddsåtgärder lämpliga för blodsmitta eftersom levande trypomastigoter är mycket invasiva. ''T. brucei rhodesiense'' är placerad i riskklass 3** av Arbetsmiljöverket (AFS 2005:1), vilket innebär att parasiten inte är luftburen men infektion genom kontaminerat blod orsakar en allvarlig sjukdom med begränsade behandlingsmöjligheter. | Vid hantering av patientmaterial beaktas skyddsåtgärder lämpliga för blodsmitta eftersom levande trypomastigoter är mycket invasiva. ''T. brucei rhodesiense'' är placerad i riskklass 3** av Arbetsmiljöverket (AFS 2005:1), vilket innebär att parasiten inte är luftburen men infektion genom kontaminerat blod orsakar en allvarlig sjukdom med begränsade behandlingsmöjligheter. | ||
| − | + | Svenska Läkaresällskapets Referensgrupp för Parasitologi har utarbetat rekommendationer och riktlinjer för laboratoriediagnostik.[http://parasitologi.se/index.php/riktlinjer_och_rekommendationer/urdjur__protozoer_/trypanosoma_brucei/] | |
===Allmänt=== | ===Allmänt=== | ||
| − | Mikroskopisk påvisning av trypomastigoter i blod och lymfkörtelaspirat är | + | Mikroskopisk påvisning av trypomastigoter i blod och lymfkörtelaspirat är enbart lämpligt för att diagnosticera det tidiga stadiet av infektionen; parasiter i cerebrospinalvätska påvisas senare, vid uppkomst av CNS-symtom. Antal parasiter i provmaterial varierar - det är störst under feberperioder. Patienter som är infekterade med ''T. brucei gambiense'' har färre parasiter i blod jämfört med patienter som är infekterade med ''T. brucei rhodesiense''. Negativt fynd utesluter inte ''T. brucei''-infektion. Upprepade provtagningar kan vara nödvändiga på grund av intermittent parasitemi. Mikroskopi tillåter inte differentiering av underarter. |
===Referensmetodik=== | ===Referensmetodik=== | ||
Mikroskopisk påvisning av trypomastigoter i tjock droppe och/eller i tunt utstryk från blod, lymfkörtelaspirat eller cerebrospinalvätska efter [[Giemsafärgning]]. | Mikroskopisk påvisning av trypomastigoter i tjock droppe och/eller i tunt utstryk från blod, lymfkörtelaspirat eller cerebrospinalvätska efter [[Giemsafärgning]]. | ||
====Avläsningskriterier==== | ====Avläsningskriterier==== | ||
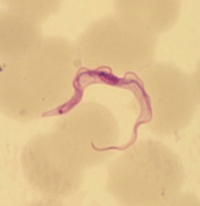
| − | Trypomastigoter av ''T. brucei'' är avlånga, ca 30 µm x 1,5 - 3,5 µm, har en | + | Trypomastigoter av ''T. brucei'' är avlånga, ca 30 µm x 1,5 - 3,5 µm, har en vågig membran utmed kroppen och fri flagell i främre delen av cellen. En centralt placerade kärnan samt kinetoplast i en bakre änden färgas violetta med Giemsafärg; cytoplasman färgas blå. |
====Kvalitetssäkring==== | ====Kvalitetssäkring==== | ||
''T. brucei''-trypomastigoter i blodutstryk ingår i UK-NEQAS utskick. | ''T. brucei''-trypomastigoter i blodutstryk ingår i UK-NEQAS utskick. | ||
| Rad 49: | Rad 49: | ||
Trypomastigoter av ''T. brucei'' påvisade | Trypomastigoter av ''T. brucei'' påvisade | ||
| − | Inga | + | Inga trypomastigoter påvisade. |
===Övriga diagnostiska metoder=== | ===Övriga diagnostiska metoder=== | ||
*Mikrohematokritmetod för mikroskopisk påvisning av trypomastigoter i blod. | *Mikrohematokritmetod för mikroskopisk påvisning av trypomastigoter i blod. | ||
| − | *QBC | + | *QBC (qualitative buffy-coat), en koncentrationsmetod för påvisning av trypomastigoter i blod. |
| − | *Serologiska metoder (immunofluorescens, ELISA) för påvisning av antikroppar mot ''T. brucei''. Serologiska metoder tillåter inte differentiering av underarter. Ett serodiagnostiskt problem är förekomsten av icke humanpatogena trypanosomer som vid infektion ger ett antikroppssvar som kan detekteras i de serologiska testen. Dessutom kan antikroppssvaret vara dåligt utvecklat vid T. b. rhodesiense-infektion, eftersom sjukomen oftast har ett hastigt förlopp. Förhöjt | + | *Serologiska metoder (immunofluorescens, ELISA) för påvisning av antikroppar mot ''T. brucei''. Serologiska metoder tillåter inte differentiering av underarter. Ett serodiagnostiskt problem är förekomsten av icke humanpatogena trypanosomer som vid infektion ger ett antikroppssvar som kan detekteras i de serologiska testen. Dessutom kan antikroppssvaret vara dåligt utvecklat vid T. b. rhodesiense-infektion, eftersom sjukomen oftast har ett hastigt förlopp. Förhöjt IgM kan vara indikativt för trypanosomainfektion. |
| − | *CATT | + | *CATT (card agglutination test), används för undersökning av antikroppssvar hos människor i endemiska områden. |
*PCR-baserade metoder för påvisning av parasit-DNA och identifiering av underarter. | *PCR-baserade metoder för påvisning av parasit-DNA och identifiering av underarter. | ||
Versionen från 24 november 2011 kl. 14.44
Huvudartikel publicerad augusti 2011. texten är preliminär, ännu ej beslutad genom konsensusförfarande.
Till innehållsförteckning för Referensmetodik:Parasitologisk diagnostik
se även Infektioner i centrala nervsystemet
Trypanosoma brucei gambiense, och T.b. rhodesiense- afrikansk trypanosomiasis, sömnsjuka
Smittämne
Afrikansk sömnsjuka hos människor orsakas av två underarter av en encellig flagellat Trypanosoma brucei. Infektioner uppträder i olika former och indelas vanligen i en västafrikansk (orsakad av T. brucei gambiense) och en östafrikansk (orsakad av T. brucei rhodesiense) trypanosomiasis. T. brucei rhodesiense är placerad i riskklass 3** av Arbetsmiljöverket (AFS 2005:1). Infektionen sprids med tsetseflugan (Glossina).
Livscykel
T. brucei förekommer i form av trypomastigoter extracellulärt i blod och cerebrospinalvätska hos infekterade människor eller reservoardjur. Trypomastigoter tas upp med blod av tsetseflugan och replikerar i insektens tarmkanal. Efter 2 veckor migrerar de till insektens salivkörtlar och utvecklas där till metacykliska former som är invasiva för människor eller djur. Vid nästa insektsbett sprutas de invasiva formerna in i såret och parasiten utvecklas extracellulärt till trypomastigoter i blod. Parasiterna delar sig och invaderar så småningom lymfkörtlar och CNS. [1]
Symtom och klinisk bild
Ett sår med svullnad utvecklas vid insektsbettet. De tidiga symtomen kan bestå av huvudvärk, yrsel, trötthet, muskelvärk och aptitlöshet. Senare tillkommer feber, svullnad av lymfkörtlar, lever och mjälte, nervsmärtor och hjärninflammation. Vid den östafrikanska formen har sjukdomen ett akut förlopp och patienten avlider vanligtvis inom några veckor. Sjukdomsbilden vid den västafrikanska formen är kronisk och karakteriseras av medvetanderubbningar och påverkan av motoriken.
Epidemiologi
Afrikansk sömnsjuka räknas som den tredje viktigaste parasitsjukdomen i världen. Sextio miljoner människor i 37 länder söder om Sahara löper risk att bli smittade och 300 000 nya fall förväntas årligen. Infektionen är kraftigt underrapporterad och WHO beräknar att tillförlitlig data finns för knapt 10 % av exponerade människor i endemiska områden. Parasiten orsakar också stora ekonomiska förluster genom att infektera och döda nötkreatur i Östafrika. Smittan förekommer i de områden i Afrika där tsetseflugan finns (15º N - 20º S latitud). Människa är huvudsaklig reservoar för den västafrikanska T. brucei gambiense som orsakar kronisk sjukdom. Över 90 % av alla rapporterade fall avser infektioner med T. brucei gambiense. Nötkreatur, samt vissa vilda djur, är reservoar för den östafrikanska T. brucei rhodesiense som orsakar den akuta formen av infektionen. Östafrikansk sömnsjuka anses vara en zoonos som sprider sig från djur till människa. Mindre än 10 % av rapporterade fall avser infektioner med T. brucei rhodesiense. Inkubationstiden vid infektion med östafrikanska formen är kort,(mellan tre dygn och tre veckor). Vid infektion med västafrikanska formen är den betydligt längre, från några månader upp till ett år. Smitta via blodtransfusion är möjlig.
Provtagning och transport
Provmaterial
- EDTA- eller kapillärblod
- Lymfkörtelaspirat
- Cerebrospinalvätska
- Serum, tas minst 2 veckor efter misstänkt infektion
Provtagning
Laboratoriediagnostik
Vid hantering av patientmaterial beaktas skyddsåtgärder lämpliga för blodsmitta eftersom levande trypomastigoter är mycket invasiva. T. brucei rhodesiense är placerad i riskklass 3** av Arbetsmiljöverket (AFS 2005:1), vilket innebär att parasiten inte är luftburen men infektion genom kontaminerat blod orsakar en allvarlig sjukdom med begränsade behandlingsmöjligheter. Svenska Läkaresällskapets Referensgrupp för Parasitologi har utarbetat rekommendationer och riktlinjer för laboratoriediagnostik.[2]
Allmänt
Mikroskopisk påvisning av trypomastigoter i blod och lymfkörtelaspirat är enbart lämpligt för att diagnosticera det tidiga stadiet av infektionen; parasiter i cerebrospinalvätska påvisas senare, vid uppkomst av CNS-symtom. Antal parasiter i provmaterial varierar - det är störst under feberperioder. Patienter som är infekterade med T. brucei gambiense har färre parasiter i blod jämfört med patienter som är infekterade med T. brucei rhodesiense. Negativt fynd utesluter inte T. brucei-infektion. Upprepade provtagningar kan vara nödvändiga på grund av intermittent parasitemi. Mikroskopi tillåter inte differentiering av underarter.
Referensmetodik
Mikroskopisk påvisning av trypomastigoter i tjock droppe och/eller i tunt utstryk från blod, lymfkörtelaspirat eller cerebrospinalvätska efter Giemsafärgning.
Avläsningskriterier
Trypomastigoter av T. brucei är avlånga, ca 30 µm x 1,5 - 3,5 µm, har en vågig membran utmed kroppen och fri flagell i främre delen av cellen. En centralt placerade kärnan samt kinetoplast i en bakre änden färgas violetta med Giemsafärg; cytoplasman färgas blå.
Kvalitetssäkring
T. brucei-trypomastigoter i blodutstryk ingår i UK-NEQAS utskick.
Svarsrutiner
Trypomastigoter av T. brucei påvisade
Inga trypomastigoter påvisade.
Övriga diagnostiska metoder
- Mikrohematokritmetod för mikroskopisk påvisning av trypomastigoter i blod.
- QBC (qualitative buffy-coat), en koncentrationsmetod för påvisning av trypomastigoter i blod.
- Serologiska metoder (immunofluorescens, ELISA) för påvisning av antikroppar mot T. brucei. Serologiska metoder tillåter inte differentiering av underarter. Ett serodiagnostiskt problem är förekomsten av icke humanpatogena trypanosomer som vid infektion ger ett antikroppssvar som kan detekteras i de serologiska testen. Dessutom kan antikroppssvaret vara dåligt utvecklat vid T. b. rhodesiense-infektion, eftersom sjukomen oftast har ett hastigt förlopp. Förhöjt IgM kan vara indikativt för trypanosomainfektion.
- CATT (card agglutination test), används för undersökning av antikroppssvar hos människor i endemiska områden.
- PCR-baserade metoder för påvisning av parasit-DNA och identifiering av underarter.
Laboratorierapportering
Infektion med Trypanosoma brucei är inte anmälningspliktig.
Litteraturhänvisningar
- Control and surveillance of African trypanosomiasis Report of a WHO Expert Committee; 1995 Geneva, Switzerland
- Maudlin I. African trypanosomiasis. 2006. Ann. Trop. Med. Parasitol.100 (8):670-701.