Skillnad mellan versioner av "Rabies (CNS)"
| (6 mellanliggande sidversioner av 2 användare visas inte) | |||
| Rad 31: | Rad 31: | ||
Även om rabies är främst en sjukdom som drabbar djur uppskattar WHO att mer än 55 000 människor årligen avlider i rabies. Majoriteten av fallen ses i Asien och Afrika men även Sydamerika rapporterar betydande antal humanfall. Övervägande delen av de som drabbas är barn < 15 år. Hund utgör den för människan i särklass farligaste smittkällan, mer än 99 % av alla fall av rabies hos människa är orsakade av hundbett. Sverige är rabiesfritt sedan mer än 100 år tillbaka. | Även om rabies är främst en sjukdom som drabbar djur uppskattar WHO att mer än 55 000 människor årligen avlider i rabies. Majoriteten av fallen ses i Asien och Afrika men även Sydamerika rapporterar betydande antal humanfall. Övervägande delen av de som drabbas är barn < 15 år. Hund utgör den för människan i särklass farligaste smittkällan, mer än 99 % av alla fall av rabies hos människa är orsakade av hundbett. Sverige är rabiesfritt sedan mer än 100 år tillbaka. | ||
| − | *[http://www. | + | *[http://www.folkhalsomyndigheten.se/amnesomraden/statistik-och-undersokningar/sjukdomsstatistik/rabies/ Folkhälsomyndigheten_Statistik för Rabies] |
===Prevention === | ===Prevention === | ||
| Rad 43: | Rad 43: | ||
Rabies bör alltid has i åtanke vid utredning av patienter med neurologisk sjukdom och som vistats i rabiesendemiskt område. Rabiesmisstanke grundas på klinisk bild och anamnes. Det är inte möjligt att förutsäga om en exponerad patient kommer att drabbas av rabies och risken för insjuknande måste bedömas efter exponeringssituationen. | Rabies bör alltid has i åtanke vid utredning av patienter med neurologisk sjukdom och som vistats i rabiesendemiskt område. Rabiesmisstanke grundas på klinisk bild och anamnes. Det är inte möjligt att förutsäga om en exponerad patient kommer att drabbas av rabies och risken för insjuknande måste bedömas efter exponeringssituationen. | ||
| − | Smittrisk, krav på specifika reagenser och nödvändigheten av ständig metodologisk träning, gör att laboratoriediagnostik endast bör utföras på speciallaboratorium. | + | Smittrisk, krav på specifika reagenser och nödvändigheten av ständig metodologisk träning, gör att laboratoriediagnostik endast bör utföras på speciallaboratorium. Folkhälsomyndigheten är det enda laboratoriet i Sverige som utför rabiesdiagnostik på humanprover. Det skall observeras att ett negativt resultat i någon av nedan beskrivna analyser talar emot, men utesluter inte diagnosen rabies och om frågeställningen kvarstår rekommenderas ny provtagning. |
| + | |||
===Provtagningsförfarande=== | ===Provtagningsförfarande=== | ||
| − | Vid misstanke om rabiesinfektion uppmanas behandlande läkare och lokala laboratorier att kontakta | + | Vid misstanke om rabiesinfektion uppmanas behandlande läkare och lokala laboratorier att kontakta Folkhälsomyndigheten för diskussion angående provtagningsförfarande. |
Vid misstanke om rabies bygger diagnostiken i första hand på påvisning av virus, virusantigen eller virusgenom. Valet av metod baseras i viss mån på vilket provmaterial som finns tillgängligt, optimalt provmaterial är hjärnvävnad. Vid ''ante mortem''-diagnostik är saliv och hårfollikelbiopsi förstahandsval men även likvor och urin är tänkbara provmaterial. Eftersom diagnosen kan vara svårfångad rekommenderas att flera olika provmaterial analyseras. | Vid misstanke om rabies bygger diagnostiken i första hand på påvisning av virus, virusantigen eller virusgenom. Valet av metod baseras i viss mån på vilket provmaterial som finns tillgängligt, optimalt provmaterial är hjärnvävnad. Vid ''ante mortem''-diagnostik är saliv och hårfollikelbiopsi förstahandsval men även likvor och urin är tänkbara provmaterial. Eftersom diagnosen kan vara svårfångad rekommenderas att flera olika provmaterial analyseras. | ||
| Rad 58: | Rad 59: | ||
*Hjärnmaterial - taget som biopsi eller obduktionsmaterial. Vid obduktion friprepareras valda delar av hjärnan och små stycken tas från ammonshorn, hjärnstam, cortex och cerebellum i båda hjärnhalvorna. Provmaterialet läggs i steril gasväv som fuktats med koksaltlösning. | *Hjärnmaterial - taget som biopsi eller obduktionsmaterial. Vid obduktion friprepareras valda delar av hjärnan och små stycken tas från ammonshorn, hjärnstam, cortex och cerebellum i båda hjärnhalvorna. Provmaterialet läggs i steril gasväv som fuktats med koksaltlösning. | ||
*Hårfollikelbiopsi utförs med engångsnål. Lätt anestesi läggs under den planerade biopsiplatsen och en biopsi på 5-6 mm diameter tas. Biopsin skall tas från hårigt område högt upp bakom örat och bör innehålla minst 10 hårfolliklar. Provmaterialet läggs i steril gasväv som fuktats med koksaltlösning. | *Hårfollikelbiopsi utförs med engångsnål. Lätt anestesi läggs under den planerade biopsiplatsen och en biopsi på 5-6 mm diameter tas. Biopsin skall tas från hårigt område högt upp bakom örat och bör innehålla minst 10 hårfolliklar. Provmaterialet läggs i steril gasväv som fuktats med koksaltlösning. | ||
| − | *Saliv samlas i två sterila rör, cirka 2-3 mL i vardera. Till det ena röret tillsätts vävnadsodlings-medium med kalvserum och antibiotika. Färdigblandat medium kan erhållas från | + | *Saliv samlas i två sterila rör, cirka 2-3 mL i vardera. Till det ena röret tillsätts vävnadsodlings-medium med kalvserum och antibiotika. Färdigblandat medium kan erhållas från Folkhälsomyndigheten. |
*Likvor (Csv)- cirka 2 mL samlas i sterilt rör utan tillsats. | *Likvor (Csv)- cirka 2 mL samlas i sterilt rör utan tillsats. | ||
*Serum - cirka 3 mL serum eller 5 mL helblod utan tillsats | *Serum - cirka 3 mL serum eller 5 mL helblod utan tillsats | ||
| Rad 87: | Rad 88: | ||
För påvisning av IgG och IgM finns indirekt IF (”in-house test”) och ELISA (kommersiell). Båda analyserna kan svaras inom 4 timmar. | För påvisning av IgG och IgM finns indirekt IF (”in-house test”) och ELISA (kommersiell). Båda analyserna kan svaras inom 4 timmar. | ||
| − | ==== Neuropatologi ==== | + | ==== Neuropatologi ==== |
| − | + | ||
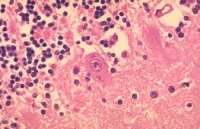
| + | [[Fil:Rabies_negri_bodies_brain.jpg|thumb|200px|right||| Rabies Negri Bodies i hjärnvävnad. ''Bild:CDC via Wikimedia Commons'']] | ||
| + | Oftast ses inga förändringar makroskopiskt. Histologiskt föreligger bilden av akut encefalit med perivaskulära rundcellsinfiltrat, mikroglia och astrocytos. Den patognomona förändringen är '''Negri bodies''' (på svenska används ibland begreppet '''Negrikroppar'''), vilka är runda eller ovala eosinofila cytoplasmatiska inklusioner, 1-7 μm i diameter. De är störst i pyramidalcellerna i hippocampus, i Purkinjecellerna i lillhjärnsbarken och i ryggmärgens framhornsceller. | ||
| + | |||
==Svarsrutiner== | ==Svarsrutiner== | ||
Text tillkommer | Text tillkommer | ||
| Rad 95: | Rad 99: | ||
== Laboratorierapportering == | == Laboratorierapportering == | ||
Rabies klassas som allmänfarlig sjukdom enligt smittskyddslagen (2004:168), och är både allmälningspliktig och smittspårningspliktig. | Rabies klassas som allmänfarlig sjukdom enligt smittskyddslagen (2004:168), och är både allmälningspliktig och smittspårningspliktig. | ||
| + | |||
| + | Anmäls enligt [[Rabies, falldefinition|gällande falldefinition]] | ||
==Referensfunktioner== | ==Referensfunktioner== | ||
| − | + | Folkhälsomyndigheten | |
== REFERENSER == | == REFERENSER == | ||
Nuvarande version från 13 januari 2014 kl. 13.19
Huvudartikel
Artikeln uppdaterad februari 2012.
Till innehållsförteckningen för Referensmetodik: Infektioner i centrala nervsystemet
och
innehållsförteckningen för Referensmetodik:Smittskyddslagens sjukdomar med Rabies, falldefinition
Rabies[redigera]
Smittämnet[redigera]
Rabiesvirus är ett höljeförsett RNA-virus. Rabiesvirus tillhör genus Lyssavirus i familjen Rhabdoviridae. Viruspartikeln har gevärskuleform och är cirka 180x75 nm i storlek. Den helikala nukleokapsiden utgörs av viralt RNA och 3 proteiner, som tillsammans reglerar virus förökning. Virus omges av ett hölje vars yttre yta är täckt av stavformade utskott som utgörs av glykoprotein. Lyssavirus förekommer i elva olika genotyper (2011). Klassiskt rabiesvirus tillhör genotyp 1 som förutom vaccinstammarna omfattar flertalet isolat från däggdjur, insektsätande fladdermöss i Nordamerika och blodsugande fladdermöss i Latinamerika. Europeisk fladdermusrabies (genotyp 5 och 6) klassificeras som rabiesbesläktat virus då fullständigt korsskydd ej förekommer mellan genotyperna.
Rabiesvirus inaktiveras av tvål och detergenter, organiska lösningsmedel, upphettning och torkning samt vid högt och lågt pH.
Patogenes[redigera]
Ytantigen (G-protein som är ett glykoprotein) anses spela stor roll för virus neurotropism genom att binda till specifika cellreceptorer.
Klinik[redigera]
Rabiesvirus orsakar sjukdom i centrala nervsystemet och utbruten sjukdom leder så gott som undantagslöst till döden. Inkubationstiden är vanligen 4-12 veckor, men kan, i undantagsfall, vara flera år. Vid bett i ansikte och hals är inkubationstiden vanligtvis kort (ca 10-14 dagar).
Sjukdomen startar med milda och ospecifika symtom som feber, huvudvärk, oro och allmän trötthet. Ett tidigt karaktäristiskt symtom som uppträder hos ca 30-70 % av patienterna är smärta eller parestesier på bettplatsen. Efter några dagar uppträder den akuta neurologiska fasen som kan förekomma i två kliniska varianter, furiös eller paralytisk rabies. Cirka 80 % av de som drabbas utvecklar den furiösa formen med bland annat hyperaktivitet, kramper, paralys och hallucinationer, periodvis uppvisas bisarrt beteende. Ett karaktäristiskt symtom som drabbar majoriteten av dessa patienter är hydrofobi ("vattuskräck"). Den paralytiska formen av rabies kan vara svår att känna igen. Den kliniska bilden domineras av en successivt tilltagande förlamning och misstas ofta för annan neurologisk sjukdom. I majoriteten av fallen inträffar döden inom ett par veckor efter symtomdebuten, vanligen till följd av andningsinsufficiens eller hjärtstillestånd.
Behandling[redigera]
Det är med korrekt post-expositionsbehandlig möjligt att effektivt förhindra sjukdom efter exposition. Behandlingen består av tre delar 1) lokal behandling med riklig tvätt (tvål och vatten) av exponerat område, 2) vaccin och 3) immunoglobulin.
Det finns ett fåtal patienter (6-7 st) som överlevt rabies. Majoriteten av dessa fick rabiesvaccin före insjuknandet. Tre patienter har överlevt rabies utan rabiesspecifikbehandling. Två av dessa behandlades enligt det så kallade Milwaukee-protokollet.
Epidemiologi[redigera]
Även om rabies är främst en sjukdom som drabbar djur uppskattar WHO att mer än 55 000 människor årligen avlider i rabies. Majoriteten av fallen ses i Asien och Afrika men även Sydamerika rapporterar betydande antal humanfall. Övervägande delen av de som drabbas är barn < 15 år. Hund utgör den för människan i särklass farligaste smittkällan, mer än 99 % av alla fall av rabies hos människa är orsakade av hundbett. Sverige är rabiesfritt sedan mer än 100 år tillbaka.
Prevention[redigera]
Vaccination i förbyggande syfte (pre-expositionsbehandling) rekommenderas till riskgrupper som i yrket kan tänkas exponeras för smitta. Pre-expositionsbehandling kan även övervägas till personer som ska vistas längre perioder i områden där vaccin inte finns att tillgå.
Vid exposition av tidigare vaccinerad person ges två boosterdoser.
Vid positiv diagnos tas omedelbart ställning till immunprofylax för vård- och laboratoriepersonal samt övriga kontakter. Boosterdoser av vaccin ges omedelbart efter en eventuell exposition, oavsett om tidigare vaccination eller ej. (eventuellt kan blodprov tas för titerbestämning hos tidigare vaccinerad, men resultatet skall inte inväntas innan booster ges).
Provtagning[redigera]
Allmänt[redigera]
Rabies bör alltid has i åtanke vid utredning av patienter med neurologisk sjukdom och som vistats i rabiesendemiskt område. Rabiesmisstanke grundas på klinisk bild och anamnes. Det är inte möjligt att förutsäga om en exponerad patient kommer att drabbas av rabies och risken för insjuknande måste bedömas efter exponeringssituationen.
Smittrisk, krav på specifika reagenser och nödvändigheten av ständig metodologisk träning, gör att laboratoriediagnostik endast bör utföras på speciallaboratorium. Folkhälsomyndigheten är det enda laboratoriet i Sverige som utför rabiesdiagnostik på humanprover. Det skall observeras att ett negativt resultat i någon av nedan beskrivna analyser talar emot, men utesluter inte diagnosen rabies och om frågeställningen kvarstår rekommenderas ny provtagning.
Provtagningsförfarande[redigera]
Vid misstanke om rabiesinfektion uppmanas behandlande läkare och lokala laboratorier att kontakta Folkhälsomyndigheten för diskussion angående provtagningsförfarande.
Vid misstanke om rabies bygger diagnostiken i första hand på påvisning av virus, virusantigen eller virusgenom. Valet av metod baseras i viss mån på vilket provmaterial som finns tillgängligt, optimalt provmaterial är hjärnvävnad. Vid ante mortem-diagnostik är saliv och hårfollikelbiopsi förstahandsval men även likvor och urin är tänkbara provmaterial. Eftersom diagnosen kan vara svårfångad rekommenderas att flera olika provmaterial analyseras.
Påvisning av antikroppar kan verifiera diagnosen hos ovaccinerad person. Dock uppträder antikroppar i serum tidigast 5-6 dagar efter symtomdebut och det finns flera fall av rabies beskrivna där patienten avlidit utan att ha påvisbara antikroppsnivåer.
Fynd av antikroppar i likvor talar för diagnosen oavsett vaccinationsstatus.
För påvisning av antikroppar efter vaccination krävs neutralisationstest.
Provmaterial[redigera]
- Hjärnmaterial - taget som biopsi eller obduktionsmaterial. Vid obduktion friprepareras valda delar av hjärnan och små stycken tas från ammonshorn, hjärnstam, cortex och cerebellum i båda hjärnhalvorna. Provmaterialet läggs i steril gasväv som fuktats med koksaltlösning.
- Hårfollikelbiopsi utförs med engångsnål. Lätt anestesi läggs under den planerade biopsiplatsen och en biopsi på 5-6 mm diameter tas. Biopsin skall tas från hårigt område högt upp bakom örat och bör innehålla minst 10 hårfolliklar. Provmaterialet läggs i steril gasväv som fuktats med koksaltlösning.
- Saliv samlas i två sterila rör, cirka 2-3 mL i vardera. Till det ena röret tillsätts vävnadsodlings-medium med kalvserum och antibiotika. Färdigblandat medium kan erhållas från Folkhälsomyndigheten.
- Likvor (Csv)- cirka 2 mL samlas i sterilt rör utan tillsats.
- Serum - cirka 3 mL serum eller 5 mL helblod utan tillsats
- Urin - cirka 3 mL urin samlas i sterilt rör.
Hjärnmaterial, hårfollikelbiopsi, saliv, likvor och urin packas i kyltransportör och sändes omgående i till laboratoriet.
Blodprov kan sändas med vanlig postgång.
Laboratoriediagnostik[redigera]
Referensmetodik[redigera]
Påvisande av virus - virusisolering[redigera]
Isolering av rabiesvirus utförs i cellkultur. Provmaterialet (saliv, hårfollikelbiopsi, likvor, hjärnmaterial) blandas med musneuroblastomceller. Efter 18 timmars inkubering fixeras cellerna och växt av virus påvisas med immunofluorescensteknik (IF). Svar kan lämnas inom 24 h efter provets ankomst till laboratoriet.
Påvisande av virusantigen – immunfluorescens (IF)[redigera]
Imprints av hjärnvävnad eller hårfollikelbiopsi undersöks med direkt IF. Vid analys av hjärnimprints har metoden både hög sensitivitet och specificitet. Metodens känslighet är dock beroende av kvaliteten på preparaten. Ett optimalt utförande kräver dessutom en tränad mikroskopist. Svar kan lämnas inom 6 timmar efter provet ankomst till laboratoriet.
Påvisande av nukleinsyra – kvalitativ/kvantitativ PCR[redigera]
För påvisning av virusgenom finns både kvalitativ och kvantitativ PCR-teknik utarbetad. Båda analyserna detekterar konserverade områden av genen som kodar för nukleoproteinet. Den kvalitativa analysen är en nestad PCR som detekterar genotyp 1-6, den kvantitativa metoden detekterar genotyp 1, 5 och 6. Provsvar kan lämnas inom 24 timmar.
Påvisande av neutraliserande antikroppar - Rapid Fluorescent Focus Inhibition test, (RFFIT)[redigera]
För kontroll av antikroppssvar efter vaccination krävs neutralisationstest. Analysen kan även användas för påvisning av antikroppar vid misstänkt rabiesinfektion. Neutralisationstestet innebär att antikropparna undersöks avseende sin förmåga att neutralisera levande rabiesvirus. I cellodlingsplatta blandas en förutbestämd mängd virus med spädningar av patientprov. Antikropp och virus tillåts binda i 90 minuter varefter BHK-21-celler tillsätts. Efter 22-24 timmars inkubering avlägsnas ovanvätskan och cellerna fixeras. Därefter färgas cellerna med immunofluorescens. Testet är kvalitativt och kvantitativt. Provet svaras i IU/mL.
Genom jämförelse med internationell standard erhålls titervärden i IU/mL. Gräns för immunitet 0,5 IU/mL. Testet diskriminerar ej mellan IgG och IgM.
Övriga diagnostiska metoder[redigera]
Antigenpåvisning[redigera]
Påvisning av virala antigen med ELISA eller rapid rabies enzyme immunodiagnosis (RREID) kan med fördel användas vid stora mängder prover, eftersom båda teknikerna relativt enkelt kan automatiseras. En annan fördel är att fluorescensmikroskop och vana vid mikroskopi ej behövs.
Serologi[redigera]
För påvisning av IgG och IgM finns indirekt IF (”in-house test”) och ELISA (kommersiell). Båda analyserna kan svaras inom 4 timmar.
Neuropatologi[redigera]
Oftast ses inga förändringar makroskopiskt. Histologiskt föreligger bilden av akut encefalit med perivaskulära rundcellsinfiltrat, mikroglia och astrocytos. Den patognomona förändringen är Negri bodies (på svenska används ibland begreppet Negrikroppar), vilka är runda eller ovala eosinofila cytoplasmatiska inklusioner, 1-7 μm i diameter. De är störst i pyramidalcellerna i hippocampus, i Purkinjecellerna i lillhjärnsbarken och i ryggmärgens framhornsceller.
Svarsrutiner[redigera]
Text tillkommer
Laboratorierapportering[redigera]
Rabies klassas som allmänfarlig sjukdom enligt smittskyddslagen (2004:168), och är både allmälningspliktig och smittspårningspliktig.
Anmäls enligt gällande falldefinition
Referensfunktioner[redigera]
Folkhälsomyndigheten
REFERENSER[redigera]
- Grandien M, Hammarin A-L. Rabies - aktuell översikt. Läkartidningen 1989;86:853-858.
- WHO Expert Consultation on Rabies. First report. WHO Technical Report Series No 931, WHO, Geneva, 2004.
- Trimarchi C V, Nadin-Davis S A. Diagnostic Evaluation. In Rabies 2nd ed. Eds: Jackson A C, Wunner W H, Oxford: Academic Press, 2007: 411-469
- McElhinney L. M, Fooks A. R, Radford A.A. Diagnostic tools for the detection of rabies. EJCAP 2008:18(3) 224-231.
- Rodney E. Willoughby, Jr., M.D., Kelly S. Tieves, D.O., George M. Hoffman, M.D., Nancy S. Ghanayem, M.D., Catherine M. Amlie-Lefond, M.D., Michael J. Schwabe, M.D., Michael J. Chusid, M.D., and Charles E. Rupprecht, V.M.D., Ph.D. Survival after Treatment of Rabies with Induction of Coma. N Engl J Med. 2005 Jun 16;352(24):2508-14.