Skillnad mellan versioner av "Entamoeba histolytica-laboratoriediagnostik"
| (8 mellanliggande sidversioner av 2 användare visas inte) | |||
| Rad 18: | Rad 18: | ||
=== Identifiering till speciesnivå/epidemiologisk typning === | === Identifiering till speciesnivå/epidemiologisk typning === | ||
| − | För identifiering av species (''E. histolytica'' eller ''E. dispar'') rekommenderas PCR. Denna teknik utförs för närvarande endast vid | + | För identifiering av species (''E. histolytica'' eller ''E. dispar'') rekommenderas PCR. Denna teknik utförs för närvarande endast vid Folkhälsomyndigheten. Metoden fungerar ej tillfredställande på formalin- eller SAF-fixerat prov varför ny provtagning erfordras. |
| − | |||
=== Referensmetodik för morfologisk screening av ''Entamoeba histolytica/dispar'' i feces === | === Referensmetodik för morfologisk screening av ''Entamoeba histolytica/dispar'' i feces === | ||
| Rad 25: | Rad 24: | ||
==== Påvisning av cystor ==== | ==== Påvisning av cystor ==== | ||
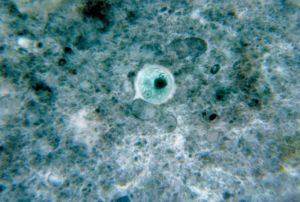
| + | [[Fil:Entamoeba histolytica 01-1-.jpg|thumb|left| Cysta av ''Entamoeba histolytica/dispar''. ''Bild Wikimedia Commons'']] | ||
| − | Cystor av ''E. histolytica/dispar'' påvisas i jodfärgat preparat efter formalin/etylacetatkoncentrering ([[Bilaga 6.]] | + | Cystor av ''E. histolytica/dispar'' påvisas i jodfärgat preparat efter formalin/etylacetatkoncentrering ([[Bilaga 6. Parasitologiska metoder]]). Observera att denna metod ej är lämplig för trofozoitpåvisning. |
| − | |||
==== Påvisning av trofozoiter ==== | ==== Påvisning av trofozoiter ==== | ||
| + | [[Fil:Trophozoites of Entamoeba histolytica with ingested erythrocytes.jpg|thumb|right| Trofozoiter av ''Entamoeba histolytica'' med intracellulära röda blodkroppar sedda som mörka inklusioner. ''Bild Wikimedia commons'']] | ||
| − | För påvisning av trofozoiter i feces s.k. färskprov, alternativt i slemhinneskrap taget vid rektoskopi eller proktoskopi, fordras ett nytaget prov. Då provet måste | + | För påvisning av trofozoiter i feces s.k. färskprov, alternativt i slemhinneskrap taget vid rektoskopi eller proktoskopi, fordras ett nytaget prov. Då provet måste undersökas så snabbt som möjligt måste patienten befinna sig i närheten av laboratoriet. |
Fecesprov granskas med avseende på slemmiga eller blodiga partier eftersom det är troligast att dessa delar innehåller trofozoiter. Materialet slammas upp i lite förvärmd 0,9 % natriumklorid och undersöks mikroskopiskt med avseende på rörliga trofozoiter. Vid fynd av amöbatrofozoiter skall det alltid anges om intracellulära erytrocyter påträffats och endast i dessa fall anges ''E. histolytica'' i svaret. Övriga trofozoiter som fyller nedan angivna morfologiska kriterier utsvaras trofozoiter av ''E. histolytica/dispar''. | Fecesprov granskas med avseende på slemmiga eller blodiga partier eftersom det är troligast att dessa delar innehåller trofozoiter. Materialet slammas upp i lite förvärmd 0,9 % natriumklorid och undersöks mikroskopiskt med avseende på rörliga trofozoiter. Vid fynd av amöbatrofozoiter skall det alltid anges om intracellulära erytrocyter påträffats och endast i dessa fall anges ''E. histolytica'' i svaret. Övriga trofozoiter som fyller nedan angivna morfologiska kriterier utsvaras trofozoiter av ''E. histolytica/dispar''. | ||
Då undersökning av “färskprov” görs på ej avdödat provmaterial måste största försiktighet iakttas i samband med handhavande av material. Vid känd smittrisk kan trikromfärgning på fixerat (och därmed avdödat) provmaterial vara ett alternativ. | Då undersökning av “färskprov” görs på ej avdödat provmaterial måste största försiktighet iakttas i samband med handhavande av material. Vid känd smittrisk kan trikromfärgning på fixerat (och därmed avdödat) provmaterial vara ett alternativ. | ||
| − | |||
==== Trikromfärgning ==== | ==== Trikromfärgning ==== | ||
| − | Om färskprov ej kan undersökas inom rimlig tidsrymd (ca 1-2 timmar) eller på grund av infektionsrisk kan provmaterial fixeras i SAF-fixativ i direkt anslut-ning till provtagningen och trikromfärgning utföras senare, eventuellt skickas till annat laboratorium. Trikromfärgning (Bilaga 6. | + | Om färskprov ej kan undersökas inom rimlig tidsrymd (ca 1-2 timmar) eller på grund av infektionsrisk kan provmaterial fixeras i SAF-fixativ i direkt anslut-ning till provtagningen och trikromfärgning utföras senare, eventuellt skickas till annat laboratorium. Trikromfärgning ([[Bilaga 6. Parasitologiska metoder]]) ger ett permanent preparat men metoden finns för närvarande endast uppsatt vid ett fåtal parasitologiska laboratorier i Sverige. |
==== Morfologiska kriterier ==== | ==== Morfologiska kriterier ==== | ||
| Rad 53: | Rad 52: | ||
Vid bacillär dysenteri kan feces innehålla stora makrofager som påminner om amöbatrofozoiter, eftersom de kan innehålla erytrocyter och ha pseudopoder. De rör sig dock ej "progressivt" som ''E. histolytica''. Unga cystor av ''E. histoly-tica/dispar'' med glykogenmassa kan förväxlas med ''Iodamoeba''-cystor. De kan emellertid lätt skiljas åt om kärnstrukturen studeras. | Vid bacillär dysenteri kan feces innehålla stora makrofager som påminner om amöbatrofozoiter, eftersom de kan innehålla erytrocyter och ha pseudopoder. De rör sig dock ej "progressivt" som ''E. histolytica''. Unga cystor av ''E. histoly-tica/dispar'' med glykogenmassa kan förväxlas med ''Iodamoeba''-cystor. De kan emellertid lätt skiljas åt om kärnstrukturen studeras. | ||
| − | Cystor av ''E. hartmanni'' är morfologiskt identiska med ''E. histolytica/dispar'' men skiljs från dessa genom sin mindre storlek. Unga cystor av ''Entamoeba coli'' har en till fyra kärnor liksom ''E. histolytica/dispar'' och det krävs noggrann | + | Cystor av ''E. hartmanni'' är morfologiskt identiska med ''E. histolytica/dispar'' men skiljs från dessa genom sin mindre storlek. Unga cystor av ''Entamoeba coli'' har en till fyra kärnor liksom ''E. histolytica/dispar'' och det krävs noggrann observation av kärnstruktur och eventuella kromatinstavar för att förväxling ej skall ske. |
| − | |||
== Alternativa diagnostiska metoder == | == Alternativa diagnostiska metoder == | ||
| Rad 76: | Rad 74: | ||
=== Serologi === | === Serologi === | ||
| − | Serologi rekommenderas för diagnostik av extraintestinal amoebiasis. Flera serologiska metoder finns att tillgå. Förekomst av antikroppar mot ''E. histolytica'' påvisade med immundiffusion i agarosgel (Ouchterlonys metod) är diagnostisk, men metodens sensitivitet vid invasiv amoebiasis är bara ca 60 %. Med | + | Serologi rekommenderas för diagnostik av extraintestinal amoebiasis. Flera serologiska metoder finns att tillgå. Förekomst av antikroppar mot ''E. histolytica'' påvisade med immundiffusion i agarosgel (Ouchterlonys metod) är diagnostisk, men metodens sensitivitet vid invasiv amoebiasis är bara ca 60 %. Med känsligare metoder såsom ELISA och immunfluorescens är känsligheten högre, 80-90 %, dock med risk för minskande specificitet. |
Serologisk diagnostik av intestinal amoebiasis har begränsad användning och bör kombineras med mikroskopi. Antikroppstitrarna kan vara låga och därmed svåra att tolka. Vid intestinal invasiv amoebiasis är känsligheten med serologisk metodik något lägre än vid extraintestinala infektioner. Fynd av amöba i feces i kombination med positiv serologi kan tala för intestinal amöbainfektion. | Serologisk diagnostik av intestinal amoebiasis har begränsad användning och bör kombineras med mikroskopi. Antikroppstitrarna kan vara låga och därmed svåra att tolka. Vid intestinal invasiv amoebiasis är känsligheten med serologisk metodik något lägre än vid extraintestinala infektioner. Fynd av amöba i feces i kombination med positiv serologi kan tala för intestinal amöbainfektion. | ||
Kvarstående förhöjda titrar av serumantikroppar mot ''E. histolytica'' kan ses hos individer från endemiska områden och göra serologisvaren svårtolkade. I tidigt stadium av invasiv amoebiasis kan serologin vara negativ. | Kvarstående förhöjda titrar av serumantikroppar mot ''E. histolytica'' kan ses hos individer från endemiska områden och göra serologisvaren svårtolkade. I tidigt stadium av invasiv amoebiasis kan serologin vara negativ. | ||
| − | |||
=== Kvalitetskontroll === | === Kvalitetskontroll === | ||
| Rad 94: | Rad 91: | ||
OBS Enbart trofozoiter som innehåller intracellulära erytrocyter kan utsvaras: trofozoiter av ''Entamoeba histolytica'' (med intracellulära erytrocyter) påvisade. | OBS Enbart trofozoiter som innehåller intracellulära erytrocyter kan utsvaras: trofozoiter av ''Entamoeba histolytica'' (med intracellulära erytrocyter) påvisade. | ||
| − | [[Kategori:Laboratoriediagnostik]] | + | [[Kategori:Laboratoriediagnostik-Infektioner i mage och tarm]] |
Nuvarande version från 13 januari 2014 kl. 10.58
Till huvudartikel: Entamoeba histolytica
Laboratoriediagnostik[redigera]
Allmänt[redigera]
Diagnostik av intestinal amöbainfektion har fram till nu främst grundat sig på mikroskopisk påvisning av parasiten i feces.
Cystor påvisas vanligen efter formalin/etylacetat koncentrering och trofozoiter i s.k. färskprov. Då utsöndring av parasiter sker intermittent rekommenderas upprepad provtagning vid negativt fynd. Någon morfologisk referensmetodik för specifik identifiering av E. histolytica-cystor finns för närvarande ej, då cystformerna av E. histolytica och E. dispar är morfologiskt identiska. Differentiering av species kan ske med PCR-metodik.
Endast förekomst av trofozoiter innehållande fagocyterade erytrocyter kan betraktas som E. histolytica, alla andra fynd är att betrakta som E. histolytica/dispar (WHO 1997).
Identifiering till speciesnivå/epidemiologisk typning[redigera]
För identifiering av species (E. histolytica eller E. dispar) rekommenderas PCR. Denna teknik utförs för närvarande endast vid Folkhälsomyndigheten. Metoden fungerar ej tillfredställande på formalin- eller SAF-fixerat prov varför ny provtagning erfordras.
Referensmetodik för morfologisk screening av Entamoeba histolytica/dispar i feces[redigera]
Påvisning av cystor[redigera]
Cystor av E. histolytica/dispar påvisas i jodfärgat preparat efter formalin/etylacetatkoncentrering (Bilaga 6. Parasitologiska metoder). Observera att denna metod ej är lämplig för trofozoitpåvisning.
Påvisning av trofozoiter[redigera]
För påvisning av trofozoiter i feces s.k. färskprov, alternativt i slemhinneskrap taget vid rektoskopi eller proktoskopi, fordras ett nytaget prov. Då provet måste undersökas så snabbt som möjligt måste patienten befinna sig i närheten av laboratoriet.
Fecesprov granskas med avseende på slemmiga eller blodiga partier eftersom det är troligast att dessa delar innehåller trofozoiter. Materialet slammas upp i lite förvärmd 0,9 % natriumklorid och undersöks mikroskopiskt med avseende på rörliga trofozoiter. Vid fynd av amöbatrofozoiter skall det alltid anges om intracellulära erytrocyter påträffats och endast i dessa fall anges E. histolytica i svaret. Övriga trofozoiter som fyller nedan angivna morfologiska kriterier utsvaras trofozoiter av E. histolytica/dispar.
Då undersökning av “färskprov” görs på ej avdödat provmaterial måste största försiktighet iakttas i samband med handhavande av material. Vid känd smittrisk kan trikromfärgning på fixerat (och därmed avdödat) provmaterial vara ett alternativ.
Trikromfärgning[redigera]
Om färskprov ej kan undersökas inom rimlig tidsrymd (ca 1-2 timmar) eller på grund av infektionsrisk kan provmaterial fixeras i SAF-fixativ i direkt anslut-ning till provtagningen och trikromfärgning utföras senare, eventuellt skickas till annat laboratorium. Trikromfärgning (Bilaga 6. Parasitologiska metoder) ger ett permanent preparat men metoden finns för närvarande endast uppsatt vid ett fåtal parasitologiska laboratorier i Sverige.
Morfologiska kriterier[redigera]
- Cystor av E. histolytica/dispar: Fullt utvecklade cystor är sfäriska och innehåller fyra kärnor. Storleken kan variera från 10-16 µm. Omogna cystor innehåller en eller två kärnor. Kärnorna har en liten kompakt centralt belägen karyosom och fint granulerat perifert kromatin. Unga cystor innehåller ibland en koncentrerad glykogenmassa som tar upp jodfärg. Avlånga kromatinkroppar med rundade ändar kan förekomma.
- Trofozoiter av E. histolytica/dispar: Storleken kan variera mellan 20-40 µm. Levande trofozoiter uppvisar progressiv rörlighet; ektoplasman i form av hyalina fingerlika pseudopoder skjuts ut och endoplasman “rinner över” i pseudopoden varvid organismen förflyttar sig. I ofärgat upplägg syns inte kärnan, medan trikromfärgade preparat i klassiska fall visar en kärna med en liten kompakt centralt belägen karyosom och med fint granulerat perifert kromatin. Endast E. histolytica kan ta upp erytrocyter. Påvisning av erytrocyter i trofozoiternas cytoplasma är en förutsättning för morfologisk klassificering av trofozoiter som E. histolytica (Gonzalez-Ruiz et al., 1994).
Diagnostiska problem vid morfologisk diagnostik:[redigera]
Vid bacillär dysenteri kan feces innehålla stora makrofager som påminner om amöbatrofozoiter, eftersom de kan innehålla erytrocyter och ha pseudopoder. De rör sig dock ej "progressivt" som E. histolytica. Unga cystor av E. histoly-tica/dispar med glykogenmassa kan förväxlas med Iodamoeba-cystor. De kan emellertid lätt skiljas åt om kärnstrukturen studeras.
Cystor av E. hartmanni är morfologiskt identiska med E. histolytica/dispar men skiljs från dessa genom sin mindre storlek. Unga cystor av Entamoeba coli har en till fyra kärnor liksom E. histolytica/dispar och det krävs noggrann observation av kärnstruktur och eventuella kromatinstavar för att förväxling ej skall ske.
Alternativa diagnostiska metoder[redigera]
Antigendetektion[redigera]
TechLab E. histolytica test är framtaget för att specifikt identifiera E. histolytica i fecesprov. Metoden bygger på detektion av specifikt E. histolytica-adhesin med ELISA. Testet är mycket specifikt men har låg känslighet. För optimalt utbyte skall analysen utföras på färska fecesprov (inom 24 timmar), vilket begränsar användbarheten.
Immuncytologiska metoder[redigera]
Monoklonala antikroppar riktade mot E. histolytica-trofozoiter har tagits fram vid några laboratorier. Metodiken har begränsad användbarhet i rutindiagnostik då den kräver initial uppodling av trofozoiter. Även monoklonaler som fungerar på trofozoiter i formalinfixerad feces finns beskrivna men finns ej kommersiellt tillgängliga. Monoklona antikroppar mot cyststadiet av E. histolytica är under utveckling men finns ej heller de kommersiellt tillgängliga. Metoden är efterlängtad för differentiering av E. histolytica/dispar.
Nukleinsyredetektion med PCR[redigera]
Specifika sökfragment för E. histolytica finns beskrivna. Metoden är tidskrävande och rekommenderas för närvarande ej för primärdiagnostik utan en¬dast för speciesidentifiering av redan påvisad E. histolytica/dispar.
Serologi[redigera]
Serologi rekommenderas för diagnostik av extraintestinal amoebiasis. Flera serologiska metoder finns att tillgå. Förekomst av antikroppar mot E. histolytica påvisade med immundiffusion i agarosgel (Ouchterlonys metod) är diagnostisk, men metodens sensitivitet vid invasiv amoebiasis är bara ca 60 %. Med känsligare metoder såsom ELISA och immunfluorescens är känsligheten högre, 80-90 %, dock med risk för minskande specificitet.
Serologisk diagnostik av intestinal amoebiasis har begränsad användning och bör kombineras med mikroskopi. Antikroppstitrarna kan vara låga och därmed svåra att tolka. Vid intestinal invasiv amoebiasis är känsligheten med serologisk metodik något lägre än vid extraintestinala infektioner. Fynd av amöba i feces i kombination med positiv serologi kan tala för intestinal amöbainfektion.
Kvarstående förhöjda titrar av serumantikroppar mot E. histolytica kan ses hos individer från endemiska områden och göra serologisvaren svårtolkade. I tidigt stadium av invasiv amoebiasis kan serologin vara negativ.
Kvalitetskontroll[redigera]
Entamoeba histolytica/dispar-cystor ingår i UK-NEQAS fecesutskick.
Svarsrutiner[redigera]
Trofozoiter alternativt cystor av E. histolytica/dispar påvisade/ej påvisade.
OBS Enbart trofozoiter som innehåller intracellulära erytrocyter kan utsvaras: trofozoiter av Entamoeba histolytica (med intracellulära erytrocyter) påvisade.