Bilaga 1b. Substratkontroll
Till innehållsförteckningen för Referensmetodik: Tarminfektioner, 2:a upplagan 2002
Bilaga 1.b
Substratkontroll
Ett stort antal olika odlingsmedia för primär isolering av tarmpatogener finns kommersiellt tillgängliga. Dessa är regelmässigt noggrant kvalitetskontrollerade av producenten, vilka på begäran bifogar analyscertifikat över aktuell lot. Detta innehåller uppgifter bl.a. om komposition, fysikaliska egenskaper, odlingsegenskaper med olika referensstammar, förvaring etc. enligt tillgängliga standarder, exempelvis NCCLS Doc M22-A. Trots detta föreligger skillnader mellan olika fabrikat av samma medium. Dessa skillnader kan avseende såväl selektiva som differentierande egenskaper uppnå statistisk signifikans, och därvid spela roll för diagnostiken. Vidare förekommer även vissa variationer mellan tillverkningsloter (batcher) av samma fabrikat, de senare sannolikt större ju mindre väldefinierat substratet är. Detta innebär att tillgängliga kommersiella halvfabrikat kan variera avseende diagnostisk förmåga, beroende på skillnader i såväl selektiva som differentierande egenskaper. Vid det enskilda laboratoriet är sedan variationer vid den fortlöpande tillverkningen inom en och samma lot oundvikliga.
Testförfarande inför upphandling av fasta substrat, referensmetod
Inför upphandling av selektiva fecessubstrat (beskrivningen avser i första hand DC-Hynes, XLD, Hektoen och CIN-agarmedier) skall jämförelse göras mellan pågående lot och prov från nya loter från en eller flera leverantörer. Loterna jämförs med avseende på selektiv och differentierande förmåga. En av loterna väljs därefter.
Den selektiva förmågan bedöms genom att studera växt av målbakterier och inhibition av normalflorans bakterier i jämförelse med växt på icke inhiberande kontrollsubstrat (uttrycks för vardera bakterieart som relative growth index, se definition nedan). Lämpligt koloniantal för målbakterier är ca , vilket motsvarar ett bakterietal som är vanligt i den diagnostiska situationen (motsvarar ca - bakterier/g feces). Koloniantalet är också lämpligt för att minimera de statistiska följderna av tekniska variationer. Den differentierande förmågan studeras genom att bedöma parametrarna kolonidiameter, allmänt koloniutseende (opak, semiopak eller genomskinlig, slät eller rå, konvex eller platt, blank eller matt) och kolonifärg (färglös, d.v.s. lika substratet, rosa/röd, gul/vit, svart, grått eller rött kolonicentrum och ev. omslag i mediet samt andra ev. notabla karakteristika).
Beträffande val av stammar för testningen är minimikravet att ur referensstamspanelerna (se under respektive patogen för målbakterier och nedan för kontaminantstammar för val och förväntat resultat) testa minst två Salmonella-, Shigella- och Yersinia-stammar samt E. coli CCUG 17 620 och E. coli CCUG 30 600 (gäller XLD, Hektoen och DC-Hynes) eller två Yersinia-stammar, E. coli enlig ovan och Citrobacter braakii CCUG 41766 (gäller CIN-agar). Principen är att utmana substraten med renkulturer av ”normala” stamtyper men också sådana målbakterier som växer dåligt och sådana kontaminanter som ofta förmår växa på selektiva substrat.
Utförande:
- 1. Slamma kolonier av utväxta bakterier från en agaryta (t.ex. blod) i 5 mL peptonbuljong med 1 % hästserum. Inkubera övernatt i 35 °C-37 °C.
- 2. Tvätta lagfaskulturerna x2 i PBS.
- 3. Späd bakteriekulturer i PBS till Mc Farland Standard 1 och sedan ned till motsvarande ca CFU/50 µL. Kontaminantkulturer späds ned till motsvarande ca 2x CFU/50 µL för att uppnå högre bakterietal på kontrollagarplattorna. Observera dock att vissa kontaminanter kräver samma spädning som målbakteriena.
- 4. Inokulera plattorna (testagar och kontrollagarplattor, som kontrollagar används CLED eller MacConkey) med vardera 50 µL i duplikat (eller triplikat) och sprid jämt över agarytan med rackla eller sterila glaskulor.
- 5. Inkubera övernatt i 35 °C - 37 °C (CIN-agar i 28 °C - 30 °C).
- 6. Räkna antalet kolonier. Vid ingen eller mycket svag växt inkuberas plattorna ytterligare ett dygn (gäller i första hand DC-Hynes). Koloniantalet bör vara ca för målbakterierna. För kontaminantstammar skall bakterietalet i fall av kraftig inhibition ligga på ca 1,5-2x på kontrollagarplattan.
- 7. Beräkna relative Growth index* (RGI) (se definition nedan).
- 8. Bedöm och notera kolonidiameter, koloniutseende och kolonifärg samt eventuella andra karakteristika.
- Relative Growth index= CFU av enskild bakterietyp på testplattan/CFU av samma bakterietyp på icke inhiberande kontrollplatta. Kvoten uttrycks i procent. Detta bör ligga över 50 % för målbakterier med god växt, men kan för målbakterier med dålig växt ligga på ett par procent. Vissa kontaminantstammar växer inte alls på testagar, detta innebär ett RGI<0,1 %, men andra stammar inhiberas i mindre omfattning (se tabell 26).
Det är fördelaktigt (hör ej till referensmetodiken) att också inokulera blandkulturer av referensstammarna bestående av en (eller ett par) typer av målbakterier i kombination med två eller helst tre olika kontaminanter. Man kan därvid jämföra substratens egenskaper i en situation som i någon mån simulerar ett kliniskt prov. Avsikten är i första hand att bedöma substratens differentierande egenskaper, d.v.s. kolonikarakteristika skall vara framträdande och enskilda arter identifierbara. Det skall observeras att growth index för en viss bakterieart som bestämts för renkultur kan ändras när samma bakterieart inokuleras tillsammans med andra bakteriearter. Förfarandet har ej standardiserats, men reproducerbara resultat kan nås med flera kombinationer (Thore, Lindman SMI-tryck 127-1999. ej i Wikiformat).
Testförfarande vid den fortlöpande tillverkningen av fasta substrat, referensmetod
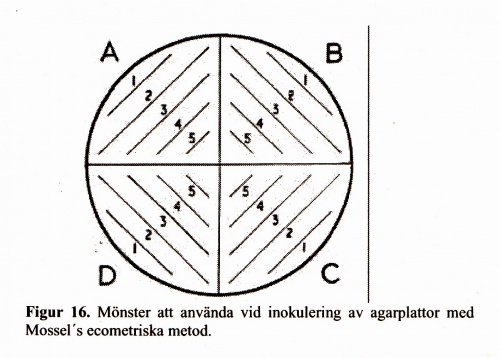
För fortlöpande tillverkningskontroll av selektiva substrat (i första hand DC-Hynes, XLD, Hektoen och CIN-agarmedier) utgör Mossel´s ecometriska metod referensmetod. Denna metod är enkel att utföra och ger uppfattning om selektiv kapacitet hos substratet. Principen är att inokulera bakterier i logfas enligt ett visst mönster på agarytan (Figur 16) och med hjälp av växt-endpoint beräkna absolut growth index (AGI, för definition se Tabell 25) och relative growth index (RGI, för definition se nedan) efter jämförelse mot växt på kontrollagar. Det är tillräckligt att testa en referensstam vardera av Salmonella, Shigella och Yersinia samt E. coli CCUG 17620.
Utförande:
- 1. Respektive bakteriekulturer inokuleras i 5 mL peptonbuljong.
- 2. Inkubera i 4 timmar i 35 °C - 37 °C.
- 3. Indela agarplattan som skall testas i fyra segment märkta A-D enligt fig 16.
- 4. Doppa en 1 µL plastinös i buljongen där bakterierna nu befinner sig i logfas. OBS! Endast själva öglan skall doppas, annars blir inokulatet för stort.
- 5. Inokulera agarplattan med plastinösen i konstant vinkel (ca 45°) enligt fig 16. (från A1 till D5).
- 6. Inokulera ytterligare en testplatta enligt moment 3-5 samt en kontrollplatta (CLED-agar eller MacConkey-agar), för varje enskild bakterietyp.
- 7. Inkubera plattorna övernatt i 35 °C - 37 °C (CIN-agar i 28 °C - 30 °C).
- 8. Notera det segment där växt sist förekommer (endpoint) på respektive test- och kontrollplattor. Vid avsaknad av växt i mer än två segment (d.v.s. två överhoppade segment) anses endpointen vara den sista med växt före avbrottet.
- 9. Absolut growth index (AGI) kalkyleras enligt nedanstående tabell 25 och relativ growth index (RGI) enligt formel (se under Tabell 25 nedan).
Krav för godkänd testning är växt på CLED-agar med ett AGI>75.
Notera det segment på respektive test- och kontrollplattor där växt sist förekommer (endpoint). Vid avsaknad av växt i två segment eller fler (d.v.s. två eller fler överhoppade segment), sker avläsning i det närmast föregående segmentet med växt.
Tabell 25. Kalkylering av absolut growth index (AGI) genom uttryckande av ett indexvärde (5-100) från noterad växt-endpoint (A1-D5):
| Kvadrant A | Kvadrant B | Kvadrant C | Kvadrant D |
|---|---|---|---|
| A1 = 5 | B1 = 10 | C1 = 15 | D1 = 20 |
| A2 = 25 | B2 = 30 | C2 = 35 | D2 = 40 |
| A3 = 45 | B3 = 50 | C3 = 55 | D3 = 60 |
| A4 = 65 | B4 = 70 | C4 = 75 | D4 = 80 |
| A5 = 85 | B5 = 90 | C5 = 95 | D5 = 1000 |
Formel för beräkning av relativ growth index (RGI):
- AGI of test x 100
- AGI of control
I Tabell 26 visas kontaminantstammar som kan användas vid kontroll av fecessubstrat. Målbakteriestammar för substratkontroller redovisas i Bilaga 2. Bakteriologiska referensmaterial
Tabell 26. Kontaminantstammar att använda som referensstammar vid lottestning och fortlöpande tillverkningskontroll av fecessubstrat enligt referensmetodiken.
| Bakterie | CCUG | ATCC | Karakteristika | Växt på XLD | Växt på DC-Hynes | Växt på CIN |
|---|---|---|---|---|---|---|
| E. coli | 17 620 | 25 922 | negativ kontroll | <0,1 | <0,1 | <0,1 |
| E. coli | 30 600 | 35 218 | ej fullständig inhibition | >25 | <1 | <0,1 |
| Citrobacter braakii | 41 766 | >50 | >25 | >75 | ||
| Proteus mirabilis | 26 767 | 24 906 | får ej svärma | >50 | >10 | <0,1 |
| P. aeruginosa | 551 | 10 145 | >25 | >10 | <0,1 | |
| Enterococcus hirae | 1332 | 8043 | negativ kontroll | <0,1 | <0,1 | <0,1 |
Avser relative growth index (uttryckt i procent) med pipetteringsteknik, d.v.s. antal CFU testagar x100/antal CFU kontrollagar (CLED eller MacConkey)
Kommentar till referensmetodiken för testning av fasta substrat
Referensmetodiken anger nivå för substratkontroll med syftet att bibehålla en hög och jämn kvalitet på de substrat som används vid fecesdiagnostiken. Lotjämförelse vid årlig upphandling skall utföras och dokumenteras. Om flera laboratorier går samman för gemensamt uppköp av ett substrat, är det tillräckligt att ett av laboratorierna utför denna lotjämförelse. Fortlöpande tillverkningskontroll på det enskilda laboratoriet skall utföras och dokumenteras. Ett acceptabelt alternativ till Mossells ecometriska metod är att rensprida renkulturer uppslammade i PBS av ett antal målbakterier och kontaminanter. En metod som också är användbar för MacConkey-agar. Härvid skall differentierande koloniparametrar jämföras mot pågående serier varför det är viktigt att fria kolonier erhålles. Observera att ingen eller ringa uppfattning därvid erhålles om substratets selektiva egenskaper.
Testförfarandet vid den fortlöpande tillverkningen av anrikningsbuljonger (Rappaport och Selenit)
Vid den fortlöpande tillverkningen (kan också gälla lottestning inför uppköp) av anrikningsbuljonger för Salmonella-bakterier rekommenderas nedanstående metoder avsedda att testa och dokumentera substratens selektiva egenskaper och förmåga att anrika Salmonella. Observera att metoderna ej standardiserats i tillräcklig omfattning och därför inte utgör referensmetodik. Principen är att utmana substratets egenskaper med metodologi som liknar den kliniska situationen. Därvid kan de inhibitoriska egenskaperna prövas genom att tillsätta ca E. coli-bakterier (lämplig stam CCUG 30600) med krav på nära nog fullständig inhibition, samtidigt som den anrikande förmågan prövas genom att tillsätta ca 10 S. Typhimurium (lämplig stam CCUG 31969) eller ca S. Senftenberg (CCUG 37886) med krav på anrikning. Alternativt kan negativ feces på bomullspinne (ca 0,02 g) tillsättas tillsammans med respektive Salmonella-stammar.
Utförande:
- 1. Mixa omsorgsfullt i 5 mL PBS kolonier av E. coli från en agaryta (t.ex. blod) eller från en tvättad övernattkultur i buljong till McFarland 1,0 (motsvarar ca >5x bakterier/mL).
- 2. Tillsätt till önskat antal rör av testbuljongen vardera 30 µL (pipett eller 3x10 µL ögla) av E. coli-suspensionen (motsvarar drygt 106 bakterier).
- 3. Förfar på samma sätt med Salmonella-stammarna men späd dessa till McFarland 0,5 och därefter ytterligare till lämplig koncentration (cirka 1,5x bakterier/mL av S. Typhimurium och 1,5x bakt/mL av S. Senftenberg).
- 4. Tillsätt 10 µL (pipett eller 10 µL ögla) av vardera Salmonella-suspension till de rör där E. coli inokulerats.
- 5. Observera att det är lämpligt att från varje suspension göra viable count i detta skede.
- 6. Inkubera rören övernatt i angiven temperatur.
- 7. Sprid med 1 µL ögla på XLD (Hektoen), MacConkey och CLED.
Förväntat resultat: Salmonella anrikas och ger därvid riklig utväxt på XLD (Hektoen); säkrast resultat med Rappaport vid 41,5 °C ± 0,5 °C inkuberingstemperatur. Enstaka växt av E. coli kan förekomma. MacConkey- och CLED-plattor används som stödjande kontrollplattor, och förväntas ge mer uttalad växt av E. coli.
REFERENSER
- Taylor, W.I. Isolation of Shigellae. Xylose, Lysine Agars; New media for the isolation of enteric pathogens. Am J Clin Path 1965;44:471-475.
- Hynes. M. The isolation of intestinal pathogens by selective media. J Path Bact 1942;54:193-207.
- King, S. and Metzger, W.I. A new plating medium for the isolation of enteric pathogens. Hektoen enteric agar. Appl. Microbiol 198;16:577.
- Leifson, E. New Selenite enrichment media for isolation of typhoid and paratyphoid (Salmonella) bacilli. Am J Hyg 1936;24:423-432.
- Peterz, M et al. The effect of incubation temperature and magnesium chloride concentration on growth of Salmonella in home-made and in commercially available dehydrated Rappaport-Vassiliadis broths. J Appl Bacteriology.1989;66:523-528.
- Vassiliades P. The Rappaport Vassiliades (R.V.) enrichment medium for the isolation of Salmonella: An overview. J Appl Bacteriol 1983;56:69-76.
- Schiemann, D.A. Synthesis of a Selective agar medium for Yersinia enterocolitica, Can J Microbiol 1979;25:1298-1304.
- Blom et al. Evaluation of Statens Serum Institut Enteric Medium for detection of enteric pathogens. J Clin Microbiol. 1999;37:2312-2316.
- Marler et al. Comparison of five cultural procedures for isolation of Clostridium difficile from stools. J Clin Microbiol. 1992;30:514-516.
- George WL, Sutter VL, Citron D, Finegold SM. Selective and differential medium for isolation of Clostridium difficile. J Clin Microbiol 1979;9:214,
- MacConkey, A.T. Lactose – fermenting bacteria in faeces J Hyg (Camb), 1905;5:333-379.
- West et al. Statistical evaluation of a quality control method for isolation of pathogenic Vibrio species on selected TCBS agars. J Clin Microbiol. 1982;16:1110-1116.
- The Oxoid Manual 7th edition 1995 sid 2-171
- Gästrin B, Kallings L O and Marcetic A. The survival time for different bacteria in various transport media. Acta Path Microbiol Scand 1968;74:371-380.
- Wang, W-L, et al. Evaluation of transportmedia for Campylobacter jejuni in human fecal specimens. J Clin Microbiol 1983;18:803-807.
- CEN pr EN TC 140/WG7/N22E. Culture media for microbiology-performance criteria for culture media.
- Hyde, W.A. Quality control in medical bacteriology, a practical approach. Chapter 10. eds Hawkey and Lewis, 1989.
- Miller, J.M. Quality control of Media, reagents and stains. Chapter 20. In Manual of Clinical Microbiology, 4th edition, 1990.
- Mossel et al. Quality assurance of selective culture media for bacteria. J Appl Bacteriology. 1983;54:313-327.
- NCCLS Document M22-A. Vol 10. No 14. 1990. Quality assurance for commercially prepared microbiological culture media.
- Rautio N. Performance criteria for culture media. Examensarbete 10p. Avd klin mikrobiol, UAS, 1995.
- M Thore, R Lindman. Utvärdering av mikrobiologiska substrat för faecesdiagnostik och metoder för kontroll av sådana substrat. SMI-tryck nr 127-1999.
- Weenk. Microbiological assessment of culture media: comparison and statistical evaluation of methods. Int J Food Microbiol 1992;17:159-81.