Acanthamoeba spp.
Huvudartikel, publicerad augusti 2011.
Till innehållsförteckningen för Referensmetodik:Parasitologisk diagnostik
Acanthamoeba spp.[redigera]
Smittämne[redigera]
Acanthamoeba-arter betraktades länge som ofarliga frilevande amöbor eftersom det inte fanns indikation på att intag via mat eller dryck kunde orsaka sjukdom. Släktet Acanthamoeba omfattar mer än 20 arter beskrivna på basen av morfologiska och biokemiska skillnader. Deras patogenicitet och virulens varierar och ungefär hälften av de kända arterna kan orsaka infektioner. Molekylärbiologiska studier beskriver ett antal olika genotyper istället för arter. Genotyp T4 är det vanligaste fyndet i kliniskt material.
Livscykel[redigera]
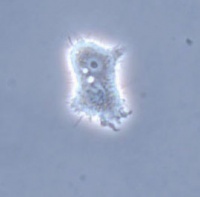
Acanthamoeba-arter är fakultativa parasiter som kan utvecklas i både miljö och värd. Deras livscykel består av två stadier: cyst- och trofozoitform. Cystorna varierar i storlek från 12 till 30 µm, är runda eller polygonala med dubbla väggar, och är motståndskraftiga mot uttorkning, kemikalier samt temperaturvariationer. Trofozoiterna är större än cystorna, 25 till 40 µm, har tunna, spetsiga pseudopodier (acanthopodia), en stor kärna och en framträdande prominent, pulserade vakuol. Trofozoiter omvandlas till cystor när omgivningen blir ogynnsam.
Symtom och klinisk bild[redigera]
Acanthamoeba spp. är opportunister som kan invadera människan och i sällsynta fall orsaka infektioner, framförallt i hjärna och ögon. Både cystor och trofozoiter betraktas som infektiösa. Smittan överförs genom inandning eller genom att skadad hud eller hornhinna kommer i direkt kontakt med kontaminerat jord eller vatten.
Granulomatös amöbaencefalit (GAE) finns beskriven hos kroniskt sjuka, immunsupprimerade och transplantationspatienter. Förändringar i hjärnan består av granulomatös infiltration, nekros och blödningar. Kroniska hud-och luftvägsinfektioner och disseminerade infektioner vid aids finns också beskrivna. Infektionen uppstår genom hematogen spridning från ett primärfokus i hud eller slemhinna. Acanthamoeba-infektion hos immunkompetenta personer orsakar hornhinneulceration – Acanthamoeba-keratit (AK). Infiltration av hornhinna utvecklas till ett smärtsamt sår och kan leda till försämrad syn och i vissa fall blindhet.
Epidemiologi[redigera]
Acanthamoeba spp. förekommer globalt och finns i alla vattenrelaterade miljöer samt jord, damm och luft. Infektioner med Acanthamoeba är sällsynta trots att amöborna är allmänt förekommande och exponeringsrisken är hög. Patogena egenskaper hos Acanthamoeba upptäcktes relativt sent. Det första fallet av hjärninfektion (GAE) noterades 1972 och några hundra fall finns beskrivna i världen. Det första fallet av Acanthamoeba-keratit (AK) publicerades 1974. I USA rapporteras årligen AK hos 2 av en miljon linsbärare. I England och Skottland är incidensen 15 gånger högre. Infektionen är tydligt förknippad med användning av mjukkontaktlinser. Linser som exponeras för kontaminerat vatten är den mest signifikanta riskfaktorn för Acanthamoeba-keratit i Europa och USA. Acanthamoeba-infektion är inte anmälningspliktig i Sverige och prevalensen är osäker. Vid Folkhälsomyndigheten diagnosticeras 1 till 2 AK-fall årligen.
Provtagning och transport[redigera]
Provmaterial[redigera]
- Biopsi eller skrap från hornhinna
- Kontaktlinser
- Kontaktlinsvätska
- Cerebrospinalvätska
- Hjärnbiopsi, hudbiopsi
Provtagningsföreskrifter[redigera]
Lägg biopsi eller hornhinneskrap i ett sterilt rör med Page’s saltlösning (PAR 10 ) eller i steril 0, 9% NaCl. Fyll röret upp till kanten med saltlösning för att förhindra att provmaterialet torkar under transporten. Ta så mycket material som möjligt eftersom undersökningens känslighet är beroende av provvolymen. Undvik att lägga eventuell skalpell i provrör eftersom den kan rosta under transporten. Skicka kontaktlinser i den linsvätska som användes sist. Flytta inte linserna till ren vätska innan transport. Om kontaktlinsvätska ska undersökas, skicka den i ursprungsförpackningen.
Förvaring/transport[redigera]
Provtagning och transport avråds på fredagar, eftersom försändelsen inte når laboratoriet förrän tidigast på måndag. Snabb transport främjar överlevnad av trofozoiter i provmaterialet och kan ge snabbare odlingsresultat. Cystor är mer motståndskraftiga och tål både längre transport och viss förvaring i kylskåpstemperatur. Provmaterialet får inte frysas.
Laboratoriediagnostik[redigera]
Allmänt[redigera]
Laboratoriediagnostik av Acanthamoeba-infektion sker genom påvisning av parasiter i vävnadsmaterial efter odling eller specifik färgning. Både cystor och trofozoiter kan påträffas i vävnader. Påvisning av antikroppar är utan diagnostisk betydelse.
Referensmetod[redigera]
Odling av infekterat material på non-nutrient agar tillsammans med artbestämda bakterier (t.ex. E. coli, K12) (PAR 10 ). Både trofozoiter och cystor utvecklas i odling. Diagnosen kan styrkas genom morfologisk identifiering av parasiter i permanentfärgade preparat. T.ex. kan imprint-preparat från positiv agarkultur färgas med Giemsafärg.
Avläsningskriterier[redigera]
Odlingsplattor granskas dagligen under en vecka i inverterat mikroskop. Trofozoiter i kultur kan variera i storlek och form. Deras cytoplasma har en stor kontraktil vakuol som tömmer sig flera gånger per minut. Cystor i kultur utvecklas efter ett par dagar. De är runda eller polygonala med tjocka väggar och påminner om kristaller. I permanentfärgade preparat har cytoplasman hos trofozoiter ett ”luftigt” utseende på grund av många små vakuoler, som kan innehålla bakterier. Allt kromatin finns samlat i en stor endosom i kärnan som färgas röd i Trikrom och röd-violett i Giemsa. Kärnmembranet, som saknar kromatin, får samma färg som cytoplasman. Flera kärnor kan förekomma i trofozoiter från kultur. Cystor har ljusfärgade dubbla väggar och mörkare cytoplasma med en kärna. Den inre cystväggen har en veckad form som ibland liknar en blomma eller en stjärna.
Kvalitetssäkring[redigera]
Identifiering av Acanthamoeba ingår inte i UK-NEQAS-utskick.
Svarsrutiner[redigera]
Cystor eller trofozoiter av Acanthamoeba spp. påvisade.
Inga cystor eller trofozoiter av Acanthamoeba spp. påvisade.
Övriga diagnostiska metoder[redigera]
- Levande parasiter kan påvisas i preparat från cerebrospinalvätska, hornhinna eller linsvätska genom direktmikroskopi.
- Cystor innehåller cellulosa och kan därför färgas med Calcofluor White.
- Trikrom-, Giemsa- och hematoxylin-färgningar kan användas som permanentfärgningar för påvisning av trofozoiter.
- Vävnadspreparat kan färgas med hematoxylin-, Gomori’s-, silver-methenamin-färgning eller genom immunhistologisk färgning med artspecifika antikroppar. Både cystor och trofozoiter kan förekomma i vävnader.
- Gramfärgning är olämplig för påvisning av Acanthamoeba.
- Befintliga PCR-metoder för påvisning av parasit-DNA i vävnader är inte tillräckligt utvärderade och används oftast enbart i forskningssyfte. Genotypning av isolerade parasiter utförs inte vid rutindiagnostik.
Laboratorierapportering[redigera]
Infektioner med Acanthamoeba spp. är inte anmälningspliktiga enligt smittskyddslagen.
Övrig information[redigera]
Balamuthia mandrillaris orsakar samma typ av hjärn- och hudinfektion som Acanthamoeba spp. Hjärninfektion med en annan nyupptäckt amöba, Sappinia pedata, rapporterades 2001. I rapporten beskrivs infektion utan granulomatös infiltration hos en immunkompetent person med en historia av sinusit strax innan hjärnsymtomen kom. Fallet diagnostiserades efter histopatologisk granskning av hjärnvävnad. Sappinia växer på agar och har trofozoiter med två kärnor.
Litteraturhänvisningar[redigera]
- Dart JK, Saw VP, Kilvington S. Acanthamoeba keratitis: diagnosis and treatment update 2009. Am J Ophthalmol. 2009; 148(4):487-499.
- Foulks GN. Acanthamoeba keratitis and contact lens wear: static or increasing problem? Eye Contact Lens. 2007; 33: 412-4; discussion 424-5.
- Khan NA. Acanthamoeba: biology and increasing importance in human health. FEMS Microbiol Rev. 2006; 30(4):564-95.
- Nilsson SE, Montan PG. The hospitalized cases of contact lens induced keratitis in Sweden and their relation to lens type and wear schedule: results of a three-year retrospective study. CLAO J. 1994;20:97–101.
- Panjwani N. Pathogenesis of Acanthamoeba keratitis. Ocul Surf. 2010; 8(2):70-9.