Bilaga 2. Bakteriologiska referensmaterial
Till innehållsförteckningen för Referensmetodik: Tarminfektioner, 2:a upplagan 2002
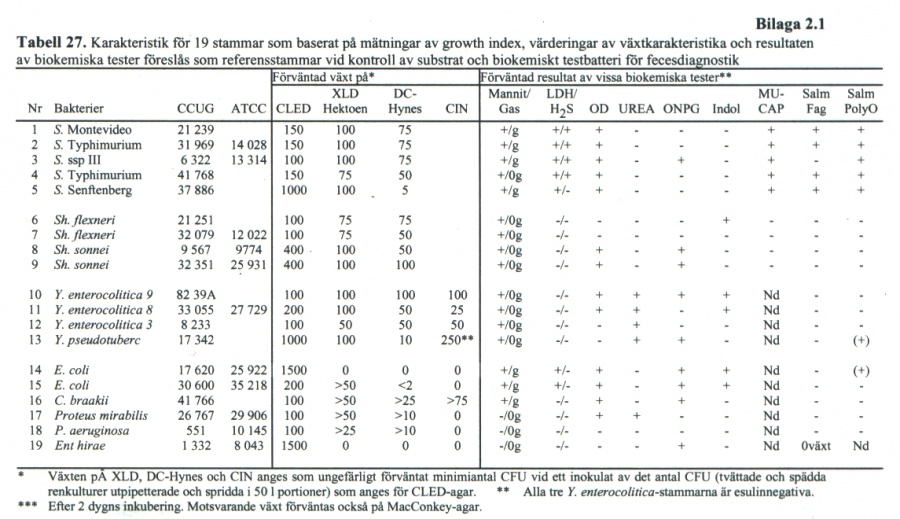
Bakteriologiska referensmaterial
Referensstammar
- För serotypning
- O4 -S. Typhimurium---- CCUG 31 969
- O7 -S. Virchow---- CCUG 12 653
- O8 -S. Newport---- CCUG 21283
- O9 -S. Enteritidis---- CCUG 34136
- O10 –S. Anatum CCUG ---- 37885
- O19 –S. Senftenberg---- CCUG 37 886
Campylobacter
- Referensstammar för substratkontroll vid varje gjutning:
- C. jejuni CCUG 11284A god växt
- E. coli CCUG 17620 hämmad helt eller delvis
- Vid lotkontroll dessutom:
- C. coli CCUG 11283 god växt
- För kontroll av odlingsförfarandet används
- C. jejuni CCUG 11284A
- För identifiering dessutom
- C. lari CCUG 23947
- C. upsaliensis CCUG 19559
Tarmpatogena E. coli
Målgener för PCR-screening
Negativ kontroll för samtliga PCR, E. coli ATCC 11775
Vibrio cholerae
- Vibrio cholerae O-1 CCUG 9119
- Vibrio cholerae O-139 CCUG 34708
Vibrionaceae
- Aeromonas hydrophila CCUG 217
- Plesiomonas shigelloides CCUG 27761
- Vibrio parahaemolyticus CCUG 27761
Helicobacter pylori
- H. pylori NCTC 11637 (CCUG 17874)
Clostridium difficile
C. difficile ATCC 9689 används för kontroll av CCFA-plattor, som jämförelse vid luppmikroskopi, som kontroll på den anaeroba miljön och som kontrollstam vid eventuell resistensbestämning
Kontaminantstammar att använda som referensstammar vid lottestning och fortlöpande tillverkningskontroll av fecessubstrat enligt referensmetodiken.
Matförgiftningsstammar
- Bacillus cereus CCUG 10 781
- Clostridium perfringens CCUG 1795
- Staphylococcus aureus CCUG 17 621
Referenssera
- Salmonella
- Polyvalent O-antiserum (Reagensia AB)
- Polyvalent H-antiserum (Reagensia AB)
- Faktorantiserum (Reagensia AB)
- Shigella
- Sh. dysenteriae 1-13 (Reagensia AB)
- Sh. flexneri (Reagensia AB)
- Sh. flexneri monoklonaler (Reagensia AB)
- Sh. boydii 1-18 (Reagensia AB)
- Sh. sonnei SoR (Reagensia AB)
- Yersinia
- Yersinia O3 och O9 (Reagensia AB)
- Vibrio cholerae
- Vibrio cholerae Polyvalent O-1 (Denka Seiken)
- Vibrio cholerae O-139 (Denka Seiken)
- EHEC
- Escherichia coli O-157 (Denka Seiken)
Salmonella-utskick S1-10/2002
Syfte
Tidigare SMI-utskick avseende Salmonella-diagnostik har i huvudsak varit inriktade på de kvalitativa komponenterna av metodologin. Det nu aktuella utskicket, som finansierats av SMI, var i huvudsak inriktat på den kvantitativa komponenten bland annat för att utröna möjligheten att definiera gränsvärden (kalibreringsnivåer) som varje lab bör ha som målsättning att klara.
Panel
Panelen bestod av 10 prov i blandkulturer med varierande koncentrationer av målbakterierna och fasta koncentrationer av kontaminanter. Målbakterierna utgjordes av två stammar av Salmonella-bakterier. Den ena av dessa, S. Montevideo CCUG 21239, är att betrakta som ”normalvariant” i så motto att den är relativt lättpåvisad på selektiva agarmedier och har en normal biokemi. Den andra, S. Senftenberg CCUG 37886, växer betydligt sämre än den första stammen och döljer sig lätt i den kontaminerande bakgrundsfloran eftersom den är H2S-negativ, men poly-O, fag- och MUCAP-positiv. Dessa grundkarakteristika för målbakterierna med tillägget att växt inte kunde förväntas från alla prov beskrevs i följebrevet.
Samtliga prov innehöll dessutom samma mängd, totalt 10e6 CFU/mL, av E. coli CCUG 30600, Citrobacter braakii CCUG 41766, Proteus mirabilis CCUG 26767 och Enterococcus hirae CCUG 1332. På grund av panelens höga svårighetsgrad rekommenderades att utstryket skulle ske enligt föreslagen referensmetodik med primär-, sekundär- och tertiärstryk för att öka chansen att erhålla fria kolonier.
Resultat och diskussion
Använda substrat (Tabell 28)
Vid primärodling använde 26 av deltagande 29 lab XLD-agar, varvid åtta lab bara använde XLD, 15 XLD i kombination med DC-agar, i kombination med SSI-agar (1 lab) eller Blå/Drigalski-agar (2 lab). Tre lab använde enbart DC-agar. Uppgift saknades ofta beträffande vilken typ av DC-agar (Leifson eller Hynes) som användes. Samtliga lab använde anrikningsbuljong varav de flesta (23 lab) Rappaport. Substraten var i stort sett de samma som vid föregående utskick 1998.
Värt att notera är att 6 lab tillverkade egen Rappaportbuljong vilket för just denna buljong enligt litteraturuppgifter t.o.m. kan vara att föredra framför något av halvfabrikaten. Fjorton lab anrikade i 37 ºC enligt rekommendationer i tidigare referensmetodik. Denna rekommendation är nu ändrad till 41,5 + 0,5 ºC i 24 timmar under förutsättning att recept enligt ref metodik används, d.v.s. tillsats av MgCl2 * 6H20, 29,0 g/L (motsvarade MgCl2 13,4 g/L). Den högre inkubationstemperaturen minskar avsevärt mängden normalflora som växer ut vid utsådd efter anrikning.
Isoleringsfrekvens (Tabell 29)
Totalt tjugosju av 29 lab isolerade korrekt Salmonella-bakterier från provserie 1-5 (S. Senftenberg). Att så många lab lyckades identifiera Salmonella från denna serie skiljer sig radikalt från resultatet 1998 då endast 4/25 lab klarade detta. Skillnaden torde förklaras av att man denna gång var förberedd på möjligheten av svårdiagnostiserad Salmonella, eftersom koncentrationerna av målbakterierna i 1998 års utskick var de samma som i prov 3 och 4 i det nu aktuella. Liksom vid föregående tillfälle 1998 lyckades samtliga lab identifiera Salmonella-bakterier som i aktuellt utskick fanns i provserie 6-10 (S. Montevideo).
Primärodling på fast medium
Det framgår av tabell 29 att de två serierna innehöll stigande koncentrationer av respektive målbakterie. Beträffande S. Senftenberg lyckades 21 av de 29 laboratorierna isolera denna redan från någon av primärplattorna i något eller flera av proven. De flesta (15 lab) hittade den därvid första gången i prov 4, d.v.s. vid koncentrationen 4,4x10e4 bakterier/mL och tre lab hittade den redan i prov 3, motsvarande 6,0x10e3 bakterier/mL. Detta innebär kumulativt att 18 av de 21 laboratorierna som påvisade bakterien på någon av primärplattorna hade gjort detta vid konc 4,4x10e4 bakterier/mL.
S. Montevideo var uppenbarligen lättare att isolera från primärplattorna. Alla lab klarade detta. Sex isolerade bakterien redan i någon av de lägsta koncentrationerna (<1- bakterier/mL) vilket måste betecknas som mycket bra. Vid koncentrationerna 2,7x10e2 (prov 8) och 2,6x10e3 (prov 9) bakterier/mL hittade 12 och 9 lab bakterien första gången, kumulativt resultat framgår av tabellen. Dessa nivåer befinner sig i området för den teoretiska nedre gränsen för vad som är möjligt att påvisa med nuvarande metodik (d.v.s. ca 10e3 Salmonella/gram feces). Vi konstaterar alltså att mot den identiska bakgrundsfloran kunde ”normal” H2S-bildande Salmonella identifieras på primärplattorna i koncentrationer som låg drygt två tiopotenser lägre än för svårodlad H2S-negativ Salmonella.
Panelens utformning tillåter inga slutsatser beträffande effektiviteten hos olika agarkombinationer. Där hänvisar vi till resultat av tidigare Salmonella/Shigella-utskick som talar för kombination av XLD och DC.
Anrikning
Betydelsen av men också begränsningarna med anrikningsförfarande illustrerades tydligt av den aktuella panelen. Antalet lab som isolerade S. Senftenberg ökade från 21 till 27 efter anrikning. Sex lab isolerade bakterierna i en koncentration som var lägre än den som redan blivit positiv på någon av primärplattorna. Detta är en statistisk signifikant (p<0,007) sänkning av detektionsnivån för dessa lab jämfört med primärodlingen. Tio lab kunde dock inte isolera denna bakterie efter anrikning. Detta talar för att S. Senftenberg anrikas dåligt eller inte alls (vilket också visats på Västeråslaboratoriet inför utskicket). Den ökade totala isoleringsfrekvensen efter anrikningsförfarande beror troligen på inhibition av kontaminanterna så att målbakterien lättare kunnat identifieras. Det kumulativa resultat av anrikningsförfarandet framgår av tabell 29. Tjugotvå lab kunde isolera S. Montevideo efter anrikning vid koncentrationer <1- bakterier/mL. Sänkningen jämfört med detektionsnivån för primärplattorna är höggradigt signifikant (p<0,001). Vi ser alltså att känsligheten ökar med mer än en tiopotens efter anrikning ner till enstaka bakterier/mL.
Materialets storlek tillåter inte påvisandet av eventuella skillnader mel-lan olika buljonger eller inkuberingstemperaturer. Vi förordar dock Rappaport-Vassiliadis (RVS)-buljong som inkuberas i 41,5 °C +- 0,5 ºC i 24 timmar. Om man höjer temperaturen till 43 ºC eller använder högre magnesiumkoncentration än den angivna rekommenderas 48 timmar inkubering.
Lämpliga gränsvärden (kalibreringsnivåer) som varje laboratorium bör klara med panelens två referensstammar kan anges till ca 10e4 bakterier/mL för S. Senftenberg och ca 10 bakterier/mL för S. Montevideo.
Primärdiagnostik Salmonella (Tabell 30)
I tabell 30 listas den angivna metodiken för verifiering av Salmonella-isolat vid våra laboratorier. Tjugotvå lab angav därmed föreslagen referensmetodik och 19 angav dessutom andra ej kommersiella tester. Det rör sig därvid oftast om OD- och rörlighetstest vilket ju är relevant dels för diagnostiken av S. Typhi (OD-negativ) men också för Shigella (S. sonnei OD-positiv) vilka alla är orörliga. De flesta (25 lab) verifierade rutinmässigt fynd av Salmonella med agglutination i polyvalent O-antiserum.
Enligt den nu aktuella referensmetodiken räcker biokemisk diagnostik i normalfallet medan poly O bör användas som verifiering vid atypiska biokemiska utfall. Många (19 lab) använde också agglutination med poly H och serotypade dessutom sina fynd. Användandet av Salmonella-fag (i referensmetodiken angivet som alternativ till agglutination i poly O) var utbrett liksom bruket av API i oklara situationer. Slutligen använde fem lab MUCAP-test, en test med hög känslighet och specificitet vi påvisandet av Salmonella som vi gärna vill rekommendera, särskilt för att utesluta Salmonella vid atypisk biokemi.
Resistensbestämning av Salmonella-isolat
Resistensbestämning utfördes av alla 29 lab men bara på begäran av 18 av dessa. Det framgick tyvärr inte huruvida lab rutinmässigt också svarade ut resultat av resistensbestämning till klinikerna. RAF rekommenderar inte rutinmässig resistensbestämning av Salmonella-isolat. Vid eventuell resistensbestämning av Salmonella och Shigella anges som minimiurval parenteralt cefalosporin, kinolon, pivmecillinam och trimetoprim-sulfa. Denna rekommendation följdes i princip av laboratorierna, ofta med tillägg av ampicillin och ibland kloramfenikol. Resistensbestämning av Salmonella är särskilt aktuell vid septisk spridning eller inför behandling vid långvarigt smittbärarskap hos vuxna (> 6 månader).