Skillnad mellan versioner av "Resistensutveckling hos UVI-patogener"
m |
|||
| (4 mellanliggande sidversioner av samma användare visas inte) | |||
| Rad 8: | Rad 8: | ||
UVI är den efter infektioner i luftvägama vanligaste orsaken till antibiotikaförskrivning i Sverige. Eftersom behandling av UVI i primärvården vanligtvis sker utan föregående bakterieodling och resistensbestämning, är det speciellt viktigt att följa resistensutvecklingen hos urinvägspatogener. | UVI är den efter infektioner i luftvägama vanligaste orsaken till antibiotikaförskrivning i Sverige. Eftersom behandling av UVI i primärvården vanligtvis sker utan föregående bakterieodling och resistensbestämning, är det speciellt viktigt att följa resistensutvecklingen hos urinvägspatogener. | ||
| − | De urinprov som analyseras vid våra laboratorier är i olika grad selekterade, varför jämförelse av antibiotikaresistens hos urinvägspatogener är behäftad med avsevärda metodologiska problem. För att kunna följa resistensutvecklingen hos bakterier från oselekterade patienter med UVI i primärvården har svenska multicenterstudier genomförts regelbundet från 1983 till 1994 (Henning 1985-1997). Selektion har undvikits genom att prov från konsekutiva primiärvårdspatienter med UVI-symtom och bakteriuri verifierad med odling analyserats (>5x<math>10^7</math> CFU/L, ''S. saprophyticus'' >2,5x <math>10^7</math> CFU/L). Fortsättningsvis kommer endast resultat från dessa studier att diskuteras. Tabell 12 visar resistens mot respektive antibiotika/antibiotikagrupp för totala antalet isolerade bakterier i 1994 års | + | De urinprov som analyseras vid våra laboratorier är i olika grad selekterade, varför jämförelse av antibiotikaresistens hos urinvägspatogener är behäftad med avsevärda metodologiska problem. För att kunna följa resistensutvecklingen hos bakterier från oselekterade patienter med UVI i primärvården har svenska multicenterstudier genomförts regelbundet från 1983 till 1994 (Henning 1985-1997). Selektion har undvikits genom att prov från konsekutiva primiärvårdspatienter med UVI-symtom och bakteriuri verifierad med odling analyserats (>5x<math>10^7</math> CFU/L, ''S. saprophyticus'' >2,5x <math>10^7</math> CFU/L). Fortsättningsvis kommer endast resultat från dessa studier att diskuteras. '''Tabell 12''' visar resistens mot respektive antibiotika/antibiotikagrupp för totala antalet isolerade bakterier i 1994 års UVI-studie. |
| − | [[Fil: | + | [[Fil:urintabell12a.jpg|thumb|500px|center||]] |
| + | ---- | ||
| − | |||
| − | + | Eftersom antalet isolat från män var betydligt färre än från kvinnor föreligger en större osäkerhet i procentsiffrorna för män. Skillnaden i resistens mellan män och kvinnor kan i övrigt till stor del förklaras av olika fördelning av bakteriearter mellan könen. '''Tabell 13''' visar resistensmönstret för de vanligaste patogenerna. | |
| + | [[Fil:urintabell13a.jpg|thumb|500px|center||]] | ||
| − | Vid ett högt antibiotikatryck kan man få en selektion av stammar med förvärvade resistensmekanismer eller av bakteriearter med en normalt nedsatt känslighet för mediet i fråga. Eftersom fördelningen av olika bakteriearter varierar med | + | ---- |
| + | |||
| + | |||
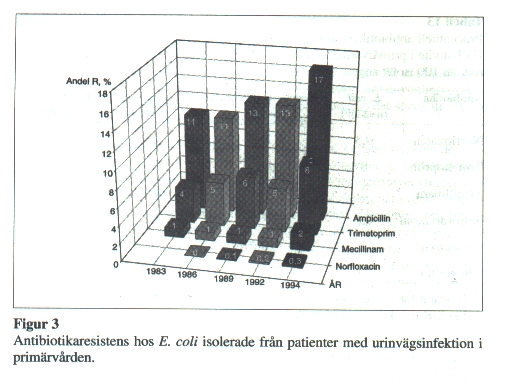
| + | Vid ett högt antibiotikatryck kan man få en selektion av stammar med förvärvade resistensmekanismer eller av bakteriearter med en normalt nedsatt känslighet för mediet i fråga. Eftersom fördelningen av olika bakteriearter varierar med patientsammansättning och mellan olika tidsperioder, är det lättare att studera resistensutvecklingen hos enskilda bakteriearter Resistensutvecklingen hos ''E. coli'', som är den vanligaste urinvägspatogenen och som utgör ca 80 % av bakterieisolaten i UVI-studierna (Henning 1985-1997), framgår av '''Figur 3'''. | ||
| Rad 26: | Rad 30: | ||
| − | Tilltagande resistens hos ''E. coli'' mot ampicillin och trimetoprim sågs under perioden 1983 till 1994 (p <0.001). En ökad risk för resistens vid förnyad infektion inom den närmaste månaden efter genomgången antibiotikabehandling förelåg för trimetoprim, mecillinam och kinoloner. För trimetoprim förelåg ökad risk för resistens upp till sex månader efter föregående behandling. | + | Tilltagande resistens hos ''E. coli'' mot ampicillin och trimetoprim sågs under perioden 1983 till 1994 (p<0.001). En ökad risk för resistens vid förnyad infektion inom den närmaste månaden efter genomgången antibiotikabehandling förelåg för trimetoprim, mecillinam och kinoloner. För trimetoprim förelåg ökad risk för resistens upp till sex månader efter föregående behandling. |
För mecillinam och norfloxacin kan man inte se någon signifikant resistensutveckling mellan åren 1983 och 1994. Detta kan antingen bero på att resistensutveckling inte förelegat, eller på att SIR-systemet under perioden 1983-1994 varit ett för trubbigt instrument för att avslöja en låggradig resistensutveckling. Första januari 1998 infördes i Sverige artrelaterade MIC- och zonbrytpunkter, varvid brytpunkterna för S/I flyttades närmare de icke resistensbärande (nativa) bakteriepopulationernas MIC-värden (Ringertz 1997). I samband härmed ändrades också definitionerna för SIR), varför andelen resistenta isolat före och efter detta datum inte kan jämföras utan att hänsyn tas till distribution av MIC-värden. Det innebär också att SIR-systemet framöver blir ett känsligare instrument för att upptäcka låggradig resistensutveckling. | För mecillinam och norfloxacin kan man inte se någon signifikant resistensutveckling mellan åren 1983 och 1994. Detta kan antingen bero på att resistensutveckling inte förelegat, eller på att SIR-systemet under perioden 1983-1994 varit ett för trubbigt instrument för att avslöja en låggradig resistensutveckling. Första januari 1998 infördes i Sverige artrelaterade MIC- och zonbrytpunkter, varvid brytpunkterna för S/I flyttades närmare de icke resistensbärande (nativa) bakteriepopulationernas MIC-värden (Ringertz 1997). I samband härmed ändrades också definitionerna för SIR), varför andelen resistenta isolat före och efter detta datum inte kan jämföras utan att hänsyn tas till distribution av MIC-värden. Det innebär också att SIR-systemet framöver blir ett känsligare instrument för att upptäcka låggradig resistensutveckling. | ||
| Rad 37: | Rad 41: | ||
*Henning C, Boström L, Dornbusch K, Furst L, Jonsson B, Wittboldt S et al. Enkla frågor kan eliminera behovet av resistensbestämning hos UVI-patienter. Läkartidningen 1985;82:948-50. | *Henning C, Boström L, Dornbusch K, Furst L, Jonsson B, Wittboldt S et al. Enkla frågor kan eliminera behovet av resistensbestämning hos UVI-patienter. Läkartidningen 1985;82:948-50. | ||
| − | *Henning C, Bengtsson S, Boström L, Dombusch K, Kahlmeter G, | + | *Henning C, Bengtsson S, Boström L, Dombusch K, Kahlmeter G, Kamme C et al. Antibiotic susceptibilities in recent Swedish urine isolates. A multilaboratory survey. Third European Congress of Clinical Microbiology. Dordrecht:ICG Printing B V,1987:150. |
| − | *Henning C, Boström L, Granlund-Edstedt M, Kahlmeter G, Lincoln K, Schwan A, Tunér K, Walder M, Östman B. Antibiotikaresistens hos UVI-bakterier Svenska Läkaresällskapets handlingar, Hygiea l989;98(häfte 5):236. Medicinsk Riksstämma poster MM 37. | + | *Henning C, Boström L, Granlund-Edstedt M, Kahlmeter G, Lincoln K, Schwan A, Tunér K, Walder M, Östman B. Antibiotikaresistens hos UVI-bakterier. Svenska Läkaresällskapets handlingar, Hygiea l989;98(häfte 5):236. Medicinsk Riksstämma poster MM 37. |
*Henning C, Östman B, Boström L. Antibiotika vid UVI i öppen vård. Dipslide med b-GUR-test och gissad antibiotikakänslighet. Kan det vara något för primärvården?’. | *Henning C, Östman B, Boström L. Antibiotika vid UVI i öppen vård. Dipslide med b-GUR-test och gissad antibiotikakänslighet. Kan det vara något för primärvården?’. | ||
Nuvarande version från 9 februari 2010 kl. 10.25
Till innehållsförteckningen för Referensmetodik: Urinvägsinfektioner/bakteriuri, 2:a upplagan 2000
Resistensutveckling hos urinvägspatogener[redigera]
UVI är den efter infektioner i luftvägama vanligaste orsaken till antibiotikaförskrivning i Sverige. Eftersom behandling av UVI i primärvården vanligtvis sker utan föregående bakterieodling och resistensbestämning, är det speciellt viktigt att följa resistensutvecklingen hos urinvägspatogener.
De urinprov som analyseras vid våra laboratorier är i olika grad selekterade, varför jämförelse av antibiotikaresistens hos urinvägspatogener är behäftad med avsevärda metodologiska problem. För att kunna följa resistensutvecklingen hos bakterier från oselekterade patienter med UVI i primärvården har svenska multicenterstudier genomförts regelbundet från 1983 till 1994 (Henning 1985-1997). Selektion har undvikits genom att prov från konsekutiva primiärvårdspatienter med UVI-symtom och bakteriuri verifierad med odling analyserats (>5x CFU/L, S. saprophyticus >2,5x CFU/L). Fortsättningsvis kommer endast resultat från dessa studier att diskuteras. Tabell 12 visar resistens mot respektive antibiotika/antibiotikagrupp för totala antalet isolerade bakterier i 1994 års UVI-studie.
Eftersom antalet isolat från män var betydligt färre än från kvinnor föreligger en större osäkerhet i procentsiffrorna för män. Skillnaden i resistens mellan män och kvinnor kan i övrigt till stor del förklaras av olika fördelning av bakteriearter mellan könen. Tabell 13 visar resistensmönstret för de vanligaste patogenerna.
Vid ett högt antibiotikatryck kan man få en selektion av stammar med förvärvade resistensmekanismer eller av bakteriearter med en normalt nedsatt känslighet för mediet i fråga. Eftersom fördelningen av olika bakteriearter varierar med patientsammansättning och mellan olika tidsperioder, är det lättare att studera resistensutvecklingen hos enskilda bakteriearter Resistensutvecklingen hos E. coli, som är den vanligaste urinvägspatogenen och som utgör ca 80 % av bakterieisolaten i UVI-studierna (Henning 1985-1997), framgår av Figur 3.
Tilltagande resistens hos E. coli mot ampicillin och trimetoprim sågs under perioden 1983 till 1994 (p<0.001). En ökad risk för resistens vid förnyad infektion inom den närmaste månaden efter genomgången antibiotikabehandling förelåg för trimetoprim, mecillinam och kinoloner. För trimetoprim förelåg ökad risk för resistens upp till sex månader efter föregående behandling.
För mecillinam och norfloxacin kan man inte se någon signifikant resistensutveckling mellan åren 1983 och 1994. Detta kan antingen bero på att resistensutveckling inte förelegat, eller på att SIR-systemet under perioden 1983-1994 varit ett för trubbigt instrument för att avslöja en låggradig resistensutveckling. Första januari 1998 infördes i Sverige artrelaterade MIC- och zonbrytpunkter, varvid brytpunkterna för S/I flyttades närmare de icke resistensbärande (nativa) bakteriepopulationernas MIC-värden (Ringertz 1997). I samband härmed ändrades också definitionerna för SIR), varför andelen resistenta isolat före och efter detta datum inte kan jämföras utan att hänsyn tas till distribution av MIC-värden. Det innebär också att SIR-systemet framöver blir ett känsligare instrument för att upptäcka låggradig resistensutveckling.
REFERENSER[redigera]
- Svensk läkemedelsstatistik 1997, Apoteket AB, sid. 240.
- Henning C, Bengtsson L. Behandling av akuta urinvägsbesvär. Enkla test och frågor underlättar diagnos och terapival. Läkartidningen 1997;94:2387.90.
- Henning C, Boström L, Dornbusch K, Furst L, Jonsson B, Wittboldt S et al. Enkla frågor kan eliminera behovet av resistensbestämning hos UVI-patienter. Läkartidningen 1985;82:948-50.
- Henning C, Bengtsson S, Boström L, Dombusch K, Kahlmeter G, Kamme C et al. Antibiotic susceptibilities in recent Swedish urine isolates. A multilaboratory survey. Third European Congress of Clinical Microbiology. Dordrecht:ICG Printing B V,1987:150.
- Henning C, Boström L, Granlund-Edstedt M, Kahlmeter G, Lincoln K, Schwan A, Tunér K, Walder M, Östman B. Antibiotikaresistens hos UVI-bakterier. Svenska Läkaresällskapets handlingar, Hygiea l989;98(häfte 5):236. Medicinsk Riksstämma poster MM 37.
- Henning C, Östman B, Boström L. Antibiotika vid UVI i öppen vård. Dipslide med b-GUR-test och gissad antibiotikakänslighet. Kan det vara något för primärvården?’.
- Svenska Läkaresällskapets handlingar, Hygiea 1992; 101 (häfte 2):256. Medicinsk Rikstämma poster 49 GP.
- Ringertz S, Olsson-Liljequist B, Kahlmeter G, Kronvall G. Antimicrobial susceptibility testing in Sweden. II. Species-related zone diameter breakpoints to avoid interpretive errors and guard against unrecognized evolution of resistance. Scand J Infect Dis 1997; Suppl: 105:8-12.