Skillnad mellan versioner av "Corynebacterium diphtheriae/C. ulcerans"
| (25 mellanliggande sidversioner av samma användare visas inte) | |||
| Rad 1: | Rad 1: | ||
| − | '' | + | '''Artikel publicerad april 2012.''' |
| − | |||
---- | ---- | ||
| + | '''Huvudartikel''' | ||
| − | |||
---- | ---- | ||
| − | + | ''Till innehållsförteckningen för [[Referensmetodik:Smittskyddslagens sjukdomar]]'' | |
| − | + | ---- | |
| − | [[ | + | ''Till förgreningssidan [[Corynebacterium diphtheriae]] för fler artiklar om bakterien'' |
| + | ---- | ||
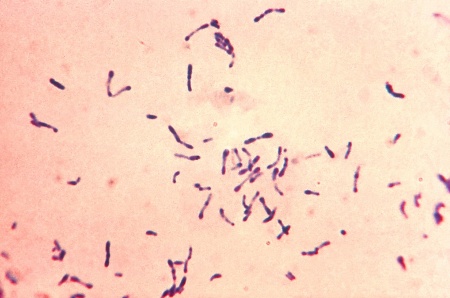
| + | [[Fil:Corynebacterium diphtheriae Gram stain.jpg|right|thumb|450px||| Gramfärgat preparat av ''Corynebacterium diphtheriae''.'' Bild CDC ID #7323 via Wikimedia Commons'']] | ||
| + | ==''Corynebacterium diphtheriae/C. ulcerans''== | ||
| + | ===Smittämnen=== | ||
| + | Difteri i smittskyddslagens mening är en sjukdom orsakad av exotoxinbildande ''Corynebacterium diphtheriae'' eller ''Corynebacterium ulcerans'' som är grampositiva difteroida stavar. Toxinet är ett värmelabilt ADP-ribosyltransferas och bildas endast av stammar infekterade med fager som bär toxingenen. Difteribakterierna lokaliseras till slemhinnor vanligen i de övre luftvägarna, ibland i konjunktiva och urogenitalia. Lokala svalginfektioner kan uppträda även med icke toxinbildande stammar. Toxinnegativa stammar kan in vivo smittas av toxigena fager från toxinbildande stam. Icke toxigena stammar av C. diphtheriae förekommer, främst i kliniska prover från individer som tidigare immuniserats mot difteritoxin. Toxinbildning förekommer även hos ''Corynebacterium ulcerans''. Sådana stammar kan ge en difteriliknande sjukdomsbild men några större epidemiska utbrott har dock inte beskrivits hos människa. | ||
| − | == | + | Även ''C. pseudotuberculosis'' kan vara toxinbildande och orsakar pseudotuberculos hos bland annat får, getter, hästar och nötkretur. Den är vanlig globalt sett, men ovanlig i Sverige. Den orsakar mycket sällan infektioner hos människa, även om den möjligen är underdiagnosticerad. |
| + | |||
| + | Den klassiska indelningen i ''C. diphtheriae gravis, intermedius'' och ''mitis'' återspeglar inte en fallande klinisk svårighetsgrad. Eftersom jäsningsmönstren för ''intermedius'' och ''mitis'' dessutom är identiska har dessa sammanförts som ''nongravis''. | ||
| + | ===Patogenes och patofysiologi=== | ||
| + | Patogeniciteten är knuten till förmågan att bilda exotoxin. Toxinet adsorberas snabbt till cellmembranerna. Efter cellpenetration blockeras proteinsyntesen, vilket resulterar i irreversibel cellskada och celldöd. Affiniteten tycks vara störst till hjärta, njurar, och nervsystem. I slemhinnan utvecklas inom ett par dagar typiska membraner vilka kan sprida sig över stora områden. | ||
| + | ===Symtom och klinisk bild=== | ||
| + | Efter en inkubationstid på vanligen 2-5 dagar debuterar sjukdomen oftast som en faryngit som i vaccinerade populationer kan vara mycket lindrig. I mer uttalade fall tillstöter feber, ömmande halslymfkörtlar och membranbildning. Vid spridning till larynx, trakea och bronker kan obstruktion av luftvägarna uppstå (äkta krupp). I svåra fall ses kraftig toxisk påverkan och hjärtkomplikationer med myokardit, neurologiska komplikationer i form av polyneuriter samt tubulär njurskada med proteinuri. | ||
| + | Membranös konjunktivit är en ovanlig men allvarlig komplikation vid difteri som kan ge en keratit med svår ärrbildning och blindhet. | ||
| + | |||
| + | Huddifteri är vanlig i tropiska och subtropiska klimat. Vid den primära formen ses på extremiteterna rundade ofta multipla sår som täcks av en fast membran eller krusta som när den lossnar blottlägger ett urstansat sår med dålig läkningsförmåga. Organkomplikationer av samma typ som vid svalgdifteri förekommer men är ovanliga. | ||
| + | ===Epidemiologi=== | ||
| + | Fram till 1940-talet var difteri en vanlig och fruktad sjukdom med en morbiditet på ca 5 % och en mortalitet kring 5-10 % av dessa. I mitten av 1990-talet pågick ett större utbrott i Ryssland på grund av bristande vaccinering av vissa befolkningsgrupper. Den senaste difteriepidemin i Sverige inträffade 1984-1986. Fram till 1988 anmäldes 38 kliniska fall varav 6 dödsfall. Sedan 1990-talet finns bara enstaka fall resistrearade. Ofta har toxinbildande korynebakterier isolerats från sår där smittan skett utomlands. År 2011 diagnostiserades svalgdifteri hos ett nyanlänt flyktingbarn i Sverige. Samtliga familjemedlemmar var ovaccinerade men vaccinerades omgående och ingen insjuknade. | ||
| − | === Provtagning och transport | + | ===Prevention=== |
| − | + | Sedan vaccination med toxoid infördes i ett allmänt vaccinationsprogram på 1950-talet har sjukdomen difteri så gott som försvunnit hos fullvaccinerade. Enligt internationella rekommendationer har gränsen för immunitet lagts vid 0,1 IU/mL i seroepidemiologiska studier och partiell immunitet vid 0,01 IU. | |
| − | + | ||
| − | + | ==Provtagning och transport== | |
| − | + | *''Misstänkt svalgdifteri:'' Provtagningspinnen rullas med kraft över membraner, vita beläggningar eller inflammerade områden i svalget. Lyft helst eventuella membraner och försök få med underliggande material. | |
| − | |||
| − | |||
| − | + | Generellt rekommenderas ej ett ytterligare prov från nasofarynx eftersom sammanställningar från senaste difteriepidemin i Sverige endast visar marginellt ökat utbyte med ett sådant förfarande. I det enskilda fallet kan nasofarynxprov fortfarande vara motiverat. | |
| − | '' | + | *''Misstänkt huddifteri och annan difteri (t ex konjunktiva, vulva):'' Rengör misstänkt sårområde med steril koksalt, avlägsna eventuella krustor och rulla provtagningspinnen med kraft i såret. Vid klinisk misstanke om ögondifteri tas prov från konjunktiva och/eller kornea samt näsa och svalg med bomullsarmerad provtagningspinne som nedförs i transportmedium. |
| − | |||
| − | + | Det är viktigt med upprepad provtagning. | |
| − | *Basmedia - Referensmedia (1) | + | Transport till laboratoriet sker i Amies agar gel medium. Provet bör vara laboratoriet tillhanda inom 24 tim. I väntan på transport förvaras materialet i kylskåp. |
| − | + | *''Remiss:'' Önskan om difteriodling måste särskilt anges på remissen eftersom rutinmässig odling av difteribakterier i allmänhet ej utförs. Vid misstanke om difteri bör dessutom laboratoriet varskos per telefon eftersom substraten måste specialberedas. | |
| − | + | ==Laboratoriediagnostik== | |
| + | ===Referensmetodik=== | ||
| + | ====Primärisolering==== | ||
| + | *''Basmedia - Referensmedia'' (1) a) MTM (Modified Tinsdale’s Medium). ([[ÖLI-bilaga 5]]) b) Cystin/Tellurit blodagar ([[ÖLI-bilaga 5]]). | ||
| + | *''Utodling och inkubering:'' Utodling sker på substrat i princip innehållande hästblod/serum, tellurit och cystin. Sådana medier har god selektivitet. ''C. diphtheriae'' har förmåga att reducera cystin varvid bildas H<sub>2</sub>S som med tellurit ger en mörk telluriumförening. På blodfri agar uppträder denna som en mörkbrun halo kring kolonierna. | ||
| − | + | Fosfomycinlappar (50 μg) kan också användas för selektion. Difteribakterier är generellt resistenta mot fosfomycin och växer intill lappen. | |
| − | Inkubering i | + | Inkubering i 37 C aerobt helst med tillskott av 5 % CO<sub>2</sub>, 3 dygn. Avläsning sker efter 1, 2 och 3 dygn. |
| + | ====Avläsning, identifiering==== | ||
| + | *''Presumtiv diagnostik:'' På tellurit blodagar är typiska kolonier gråbruna till svarta. På MTM-agar en mörkbrun halo runt misstänkta kolonier ses inom 2 dygn. Sådana kan emellertid också bildas av ''C. ulcerans, C. ovis, C. pseudotuberculosis'' och vissa streptokockstammar. ''C. diphtheriae'' är katalas- och vanligen nitratpositiv. Undantag utgör subtyp belfanti som inte reducerar nitrat (1). | ||
| − | === | + | Det är viktigt med positiva kontroller eftersom MTM-mediet kan vara av ojämn kvalitet. Gramfärga misstänkta kolonier. Sök efter grampositiva eller gramlabila stavar i typisk ”pallisadformation” (se också bild). |
| + | ====Slutlig verifiering==== | ||
| + | (För substratrecept se [[ÖLI-bilaga 6]]). | ||
| + | Slutlig verifiering sker med biokemiska kriterier ('''Tabell 1'''). Kommersiella kits kan också användas. | ||
| − | |||
| − | |||
| + | '''Tabell 1. Biokemiska kriterier för diagnostik av vissa korynebakterier''' | ||
| + | {| class="wikitable" | ||
| + | |- | ||
| + | ! Bakterie !! Glukos !! Sackaros !! Glykogen !! Urea !! Halo på MTM | ||
| + | |- | ||
| + | | ''C. diphtheriae gravis''|| + || -<math>^1</math>|| + || - || + | ||
| + | |- | ||
| + | | ''C. diphtheriae nongravis''||+ || -<math>^1</math> || - || - || + | ||
| + | |- | ||
| + | | ''C. ulcerans'' || + || -|| +|| +|| + | ||
| + | |- | ||
| + | | ''C. pseudotuberculosis'' || +|| -|| -|| +|| + | ||
| + | |- | ||
| + | | ''C. xerosis''|| +|| +|| -|| -|| - | ||
| + | |- | ||
| + | | ''C. pseudodiphtericum''|| -|| -|| -|| +|| - | ||
| + | |} | ||
| − | + | <math>^1</math>''C. diphtheriae'' kan i sällsynta fall vara positiv i sackarostest | |
| − | |||
| − | |||
| − | + | *''Toxinbildning:'' Alla isolat av ''C. diphtheriae'' och ''C. ulcerans'' skall undersökas med avseende på toxinbildning. Den metod som vanligen används är geldiffusion enligt Elek-Ouchterlony. Metodbeskrivning och tolkning av toxintest (se [[ÖLI-bilaga 15]]). | |
| − | |||
| − | |||
| − | + | Flera PCR-metoder finns beskrivna och används för påvisning av toxin-genen. (Pallen, et al, 1994). Observera att en stam kan ha toxingenen utan att bilda toxin. Stammar av ''C. dihtheriae'' och ''C. ulcerans'' och sådana med osäker biokemi eller toxinbildning bör sändas till referenslaboratorium för verifiering. Även enstaka isolat utan epidemiologisk bakgrund bör sändas för verifiering. Eventuella isolat som identifieras som ''C. pseudotuberculosis'' skall också verifieras avseende toxinbildning. | |
| − | + | ====Indikationer för resistensbestämning==== | |
| + | Isolerade difteribakterier är i allmänhet känsliga för penicillin och erytromycin, varför resistensbestämning sällan blir aktuell. | ||
| + | ===Övriga metoder för påvisande av difteribakterier=== | ||
| + | *En PCR-baserad snabbmetod för diagnosen difteri finns beskriven från CDC. Här användes två primerset mot toxingenens subenheter för A och B. | ||
| − | + | *Direktpreparat för mikroskopi är ofta svårbedömda även med specialfärgningar. Såväl falskt positiva som falskt negativa resultat är vanliga. Avsaknad av grampositiva stavar i ett direktpreparat kan dock ge viss klinisk vägledning. | |
| − | + | *Kommersiella testsystem för identifikation av korynebakterier finns tillgängliga. Dessa består av en serie tester för fermentaion av olika substrat och biokemiska egenskaper (t ex. API Coryne system (Bio Merieux); Rapid ID,CB Plus system (RemelXXX)). | |
| − | + | *''[[Maldi-Tof]];'' mer omfattander erfarenheter saknas ännu men bakterierna finns medtagna i aktuella databaser som är kopplade till instrumenten. | |
| + | *''Antikroppsbestämning:'' Metodik för bestämning av difteriantitoxin behandlas i annat sammanhang. Antikroppsbestämning används sällan i diagnostiskt syfte. | ||
| − | + | ===Kvalitetskontroll=== | |
| + | * Referensstammar | ||
| + | ** ''Corynebacterium diphtheriae:'' CCUG 5863 (NCTC 3984), svagt tox + | ||
| + | ** ''Corynebacterium diphtheriae nongravis:'' CCUG 5865 (NCTC 10356), tox- | ||
| + | ** ''Corynebacterium diphtheriae gravis:'' CCUG 5864 (NCTC 10648), tox+ | ||
| + | ** ''Corynebacterium ulcerans:'' CCUG 18646, tox+ | ||
| + | |||
| + | ===Epidemiologisk typning=== | ||
| + | Tidigare använd fagtypning har nu ersatts av molekylär karakterisering. Under den senaste ryska epidemien på 1990-talet utvecklades dels ribotypning dels MEE (''multilocus enzyme electrophoresis''). Ribotypning anses vara referensmetod och för att underlätta monitorering av cirkulerande kloner har en databas för ribotyper etablerats vid Institut Pasteur.(Grimont et al, 2004). Metoden finns inte uppsatt i Sverige. | ||
| + | En annan metod vars data är jämförbara mellan olika laboratorier är Multilocus sequencing (MLST). En allmän MLST-databas finns vid University of Oxford (http://pubmlst.org/cdiphtheriae/). | ||
| − | + | För lokala epidemiologiska frågeställningar kan Multi-locus variable-number tandem repeat analysis ([[MLVA]]) användas. MLVA ger en högre upplösning vid jämförelse av olika stammar. | |
| − | + | ==Svarsrutiner== | |
| + | Stam som visar biokemi typisk för ''C. diphtheriae'' och är toxinbildande i gel-diffusionstest enligt Elek-Ouchterlony svaras ''Corynebacterterium diphtheriae gravis/non-gravis'', toxinbildande. Motsvarande stam som ej bildar toxin svaras ''Corynebacterium diphtheriae''/ej toxinbildande. Enligt motsvarande kriterier svaras stam av ''C. ulceran''s ut som ''Corynebacterium ulcerans'' / toxinbildande respektive ''Corynebacterium ulcerans'' / ej toxinbildande. | ||
| + | Eventuella fynd av ''C. pseudotuberculosis'' svaras ut enbart om de är toxinbildanade. | ||
| − | == | + | |
| + | ==Laboratorierapportering== | ||
| + | Toxinbildande ''C. diphtheriae, C. ulcerans'' och ''C. pseudotuberculosis'' är anmälningspliktiga enligt Smittskyddslagen. | ||
| + | ==Referensfunktioner== | ||
| + | Ej beslutade | ||
| − | + | ==REFERENSER== | |
| − | + | *Brooks R. Guidelines for the laboratory diagnosis of diphtheria. WHO Lab 81-7. | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | == REFERENSER == | ||
| − | |||
| − | * | ||
| − | |||
| − | |||
| − | |||
| + | *Golaz, A., Popovic, T., Wharton, M. Epidemiology of Diphtheria in the 1990s. Clin Microbiol Newslett. 2001;23:33-37. | ||
| + | |||
| + | *Grimont PA, Grimont F, Efstratiou A, De Zoysa A, Mazurova I, Ruckly C, Lejay-Collin M, Martin-Delautre S, Regnault B; European Laboratory Working Group on Diphtheria. International nomenclature for Corynebacterium diphtheriae ribotypes. Res Microbiol. 2004;155: 162-6. | ||
| + | |||
| + | *Mikhailovich, V., M., Melnikov, V., G., Mazurova, I., K., Wachsmuth, I., K., Wenger, J., D., Wharton, M.,Nakao, H., Popovic, T. Application of PCR for detection of toxigenic Corynebacterium diphtheriae strains isolated during the Russian diphtheria epidemic. J Clin Microbiol. 1995;33:3061-3063. | ||
| + | *Nakao, H., Popovic, T. Development of a direct PCR assay for detection of the diphtheria toxin gene. J Clin Microbiol. 1997;35:1651-1655. | ||
| + | *Pallen MJ, Hay AJ, Puckey LH, Efstratiou A. Polymerase chain reaction for screening clinical isolates of corynebacteria for the production of diphtheria toxin. J Clin Pathol. 1994; 47:353-6. | ||
| + | * Grimont PA et al., and the European Laboratory Working Group on Diphtheria.''International nomenclature for Corynebacterium diphtheriae ribotypes Res Microbiol. 2004 Apr;155(3):162-6. | ||
| + | |||
[[Kategori:ÖLI]] | [[Kategori:ÖLI]] | ||
| + | [[Kategori:Smittskyddslagens sjukdomar]] | ||
Nuvarande version från 8 augusti 2014 kl. 17.25
Artikel publicerad april 2012.
Huvudartikel
Till innehållsförteckningen för Referensmetodik:Smittskyddslagens sjukdomar
Till förgreningssidan Corynebacterium diphtheriae för fler artiklar om bakterien
Corynebacterium diphtheriae/C. ulcerans[redigera]
Smittämnen[redigera]
Difteri i smittskyddslagens mening är en sjukdom orsakad av exotoxinbildande Corynebacterium diphtheriae eller Corynebacterium ulcerans som är grampositiva difteroida stavar. Toxinet är ett värmelabilt ADP-ribosyltransferas och bildas endast av stammar infekterade med fager som bär toxingenen. Difteribakterierna lokaliseras till slemhinnor vanligen i de övre luftvägarna, ibland i konjunktiva och urogenitalia. Lokala svalginfektioner kan uppträda även med icke toxinbildande stammar. Toxinnegativa stammar kan in vivo smittas av toxigena fager från toxinbildande stam. Icke toxigena stammar av C. diphtheriae förekommer, främst i kliniska prover från individer som tidigare immuniserats mot difteritoxin. Toxinbildning förekommer även hos Corynebacterium ulcerans. Sådana stammar kan ge en difteriliknande sjukdomsbild men några större epidemiska utbrott har dock inte beskrivits hos människa.
Även C. pseudotuberculosis kan vara toxinbildande och orsakar pseudotuberculos hos bland annat får, getter, hästar och nötkretur. Den är vanlig globalt sett, men ovanlig i Sverige. Den orsakar mycket sällan infektioner hos människa, även om den möjligen är underdiagnosticerad.
Den klassiska indelningen i C. diphtheriae gravis, intermedius och mitis återspeglar inte en fallande klinisk svårighetsgrad. Eftersom jäsningsmönstren för intermedius och mitis dessutom är identiska har dessa sammanförts som nongravis.
Patogenes och patofysiologi[redigera]
Patogeniciteten är knuten till förmågan att bilda exotoxin. Toxinet adsorberas snabbt till cellmembranerna. Efter cellpenetration blockeras proteinsyntesen, vilket resulterar i irreversibel cellskada och celldöd. Affiniteten tycks vara störst till hjärta, njurar, och nervsystem. I slemhinnan utvecklas inom ett par dagar typiska membraner vilka kan sprida sig över stora områden.
Symtom och klinisk bild[redigera]
Efter en inkubationstid på vanligen 2-5 dagar debuterar sjukdomen oftast som en faryngit som i vaccinerade populationer kan vara mycket lindrig. I mer uttalade fall tillstöter feber, ömmande halslymfkörtlar och membranbildning. Vid spridning till larynx, trakea och bronker kan obstruktion av luftvägarna uppstå (äkta krupp). I svåra fall ses kraftig toxisk påverkan och hjärtkomplikationer med myokardit, neurologiska komplikationer i form av polyneuriter samt tubulär njurskada med proteinuri.
Membranös konjunktivit är en ovanlig men allvarlig komplikation vid difteri som kan ge en keratit med svår ärrbildning och blindhet.
Huddifteri är vanlig i tropiska och subtropiska klimat. Vid den primära formen ses på extremiteterna rundade ofta multipla sår som täcks av en fast membran eller krusta som när den lossnar blottlägger ett urstansat sår med dålig läkningsförmåga. Organkomplikationer av samma typ som vid svalgdifteri förekommer men är ovanliga.
Epidemiologi[redigera]
Fram till 1940-talet var difteri en vanlig och fruktad sjukdom med en morbiditet på ca 5 % och en mortalitet kring 5-10 % av dessa. I mitten av 1990-talet pågick ett större utbrott i Ryssland på grund av bristande vaccinering av vissa befolkningsgrupper. Den senaste difteriepidemin i Sverige inträffade 1984-1986. Fram till 1988 anmäldes 38 kliniska fall varav 6 dödsfall. Sedan 1990-talet finns bara enstaka fall resistrearade. Ofta har toxinbildande korynebakterier isolerats från sår där smittan skett utomlands. År 2011 diagnostiserades svalgdifteri hos ett nyanlänt flyktingbarn i Sverige. Samtliga familjemedlemmar var ovaccinerade men vaccinerades omgående och ingen insjuknade.
Prevention[redigera]
Sedan vaccination med toxoid infördes i ett allmänt vaccinationsprogram på 1950-talet har sjukdomen difteri så gott som försvunnit hos fullvaccinerade. Enligt internationella rekommendationer har gränsen för immunitet lagts vid 0,1 IU/mL i seroepidemiologiska studier och partiell immunitet vid 0,01 IU.
Provtagning och transport[redigera]
- Misstänkt svalgdifteri: Provtagningspinnen rullas med kraft över membraner, vita beläggningar eller inflammerade områden i svalget. Lyft helst eventuella membraner och försök få med underliggande material.
Generellt rekommenderas ej ett ytterligare prov från nasofarynx eftersom sammanställningar från senaste difteriepidemin i Sverige endast visar marginellt ökat utbyte med ett sådant förfarande. I det enskilda fallet kan nasofarynxprov fortfarande vara motiverat.
- Misstänkt huddifteri och annan difteri (t ex konjunktiva, vulva): Rengör misstänkt sårområde med steril koksalt, avlägsna eventuella krustor och rulla provtagningspinnen med kraft i såret. Vid klinisk misstanke om ögondifteri tas prov från konjunktiva och/eller kornea samt näsa och svalg med bomullsarmerad provtagningspinne som nedförs i transportmedium.
Det är viktigt med upprepad provtagning.
Transport till laboratoriet sker i Amies agar gel medium. Provet bör vara laboratoriet tillhanda inom 24 tim. I väntan på transport förvaras materialet i kylskåp.
- Remiss: Önskan om difteriodling måste särskilt anges på remissen eftersom rutinmässig odling av difteribakterier i allmänhet ej utförs. Vid misstanke om difteri bör dessutom laboratoriet varskos per telefon eftersom substraten måste specialberedas.
Laboratoriediagnostik[redigera]
Referensmetodik[redigera]
Primärisolering[redigera]
- Basmedia - Referensmedia (1) a) MTM (Modified Tinsdale’s Medium). (ÖLI-bilaga 5) b) Cystin/Tellurit blodagar (ÖLI-bilaga 5).
- Utodling och inkubering: Utodling sker på substrat i princip innehållande hästblod/serum, tellurit och cystin. Sådana medier har god selektivitet. C. diphtheriae har förmåga att reducera cystin varvid bildas H2S som med tellurit ger en mörk telluriumförening. På blodfri agar uppträder denna som en mörkbrun halo kring kolonierna.
Fosfomycinlappar (50 μg) kan också användas för selektion. Difteribakterier är generellt resistenta mot fosfomycin och växer intill lappen.
Inkubering i 37 C aerobt helst med tillskott av 5 % CO2, 3 dygn. Avläsning sker efter 1, 2 och 3 dygn.
Avläsning, identifiering[redigera]
- Presumtiv diagnostik: På tellurit blodagar är typiska kolonier gråbruna till svarta. På MTM-agar en mörkbrun halo runt misstänkta kolonier ses inom 2 dygn. Sådana kan emellertid också bildas av C. ulcerans, C. ovis, C. pseudotuberculosis och vissa streptokockstammar. C. diphtheriae är katalas- och vanligen nitratpositiv. Undantag utgör subtyp belfanti som inte reducerar nitrat (1).
Det är viktigt med positiva kontroller eftersom MTM-mediet kan vara av ojämn kvalitet. Gramfärga misstänkta kolonier. Sök efter grampositiva eller gramlabila stavar i typisk ”pallisadformation” (se också bild).
Slutlig verifiering[redigera]
(För substratrecept se ÖLI-bilaga 6).
Slutlig verifiering sker med biokemiska kriterier (Tabell 1). Kommersiella kits kan också användas.
Tabell 1. Biokemiska kriterier för diagnostik av vissa korynebakterier
| Bakterie | Glukos | Sackaros | Glykogen | Urea | Halo på MTM |
|---|---|---|---|---|---|
| C. diphtheriae gravis | + | - | + | - | + |
| C. diphtheriae nongravis | + | - | - | - | + |
| C. ulcerans | + | - | + | + | + |
| C. pseudotuberculosis | + | - | - | + | + |
| C. xerosis | + | + | - | - | - |
| C. pseudodiphtericum | - | - | - | + | - |
C. diphtheriae kan i sällsynta fall vara positiv i sackarostest
- Toxinbildning: Alla isolat av C. diphtheriae och C. ulcerans skall undersökas med avseende på toxinbildning. Den metod som vanligen används är geldiffusion enligt Elek-Ouchterlony. Metodbeskrivning och tolkning av toxintest (se ÖLI-bilaga 15).
Flera PCR-metoder finns beskrivna och används för påvisning av toxin-genen. (Pallen, et al, 1994). Observera att en stam kan ha toxingenen utan att bilda toxin. Stammar av C. dihtheriae och C. ulcerans och sådana med osäker biokemi eller toxinbildning bör sändas till referenslaboratorium för verifiering. Även enstaka isolat utan epidemiologisk bakgrund bör sändas för verifiering. Eventuella isolat som identifieras som C. pseudotuberculosis skall också verifieras avseende toxinbildning.
Indikationer för resistensbestämning[redigera]
Isolerade difteribakterier är i allmänhet känsliga för penicillin och erytromycin, varför resistensbestämning sällan blir aktuell.
Övriga metoder för påvisande av difteribakterier[redigera]
- En PCR-baserad snabbmetod för diagnosen difteri finns beskriven från CDC. Här användes två primerset mot toxingenens subenheter för A och B.
- Direktpreparat för mikroskopi är ofta svårbedömda även med specialfärgningar. Såväl falskt positiva som falskt negativa resultat är vanliga. Avsaknad av grampositiva stavar i ett direktpreparat kan dock ge viss klinisk vägledning.
- Kommersiella testsystem för identifikation av korynebakterier finns tillgängliga. Dessa består av en serie tester för fermentaion av olika substrat och biokemiska egenskaper (t ex. API Coryne system (Bio Merieux); Rapid ID,CB Plus system (RemelXXX)).
- Maldi-Tof; mer omfattander erfarenheter saknas ännu men bakterierna finns medtagna i aktuella databaser som är kopplade till instrumenten.
- Antikroppsbestämning: Metodik för bestämning av difteriantitoxin behandlas i annat sammanhang. Antikroppsbestämning används sällan i diagnostiskt syfte.
Kvalitetskontroll[redigera]
- Referensstammar
- Corynebacterium diphtheriae: CCUG 5863 (NCTC 3984), svagt tox +
- Corynebacterium diphtheriae nongravis: CCUG 5865 (NCTC 10356), tox-
- Corynebacterium diphtheriae gravis: CCUG 5864 (NCTC 10648), tox+
- Corynebacterium ulcerans: CCUG 18646, tox+
Epidemiologisk typning[redigera]
Tidigare använd fagtypning har nu ersatts av molekylär karakterisering. Under den senaste ryska epidemien på 1990-talet utvecklades dels ribotypning dels MEE (multilocus enzyme electrophoresis). Ribotypning anses vara referensmetod och för att underlätta monitorering av cirkulerande kloner har en databas för ribotyper etablerats vid Institut Pasteur.(Grimont et al, 2004). Metoden finns inte uppsatt i Sverige.
En annan metod vars data är jämförbara mellan olika laboratorier är Multilocus sequencing (MLST). En allmän MLST-databas finns vid University of Oxford (http://pubmlst.org/cdiphtheriae/).
För lokala epidemiologiska frågeställningar kan Multi-locus variable-number tandem repeat analysis (MLVA) användas. MLVA ger en högre upplösning vid jämförelse av olika stammar.
Svarsrutiner[redigera]
Stam som visar biokemi typisk för C. diphtheriae och är toxinbildande i gel-diffusionstest enligt Elek-Ouchterlony svaras Corynebacterterium diphtheriae gravis/non-gravis, toxinbildande. Motsvarande stam som ej bildar toxin svaras Corynebacterium diphtheriae/ej toxinbildande. Enligt motsvarande kriterier svaras stam av C. ulcerans ut som Corynebacterium ulcerans / toxinbildande respektive Corynebacterium ulcerans / ej toxinbildande.
Eventuella fynd av C. pseudotuberculosis svaras ut enbart om de är toxinbildanade.
Laboratorierapportering[redigera]
Toxinbildande C. diphtheriae, C. ulcerans och C. pseudotuberculosis är anmälningspliktiga enligt Smittskyddslagen.
Referensfunktioner[redigera]
Ej beslutade
REFERENSER[redigera]
- Brooks R. Guidelines for the laboratory diagnosis of diphtheria. WHO Lab 81-7.
- Golaz, A., Popovic, T., Wharton, M. Epidemiology of Diphtheria in the 1990s. Clin Microbiol Newslett. 2001;23:33-37.
- Grimont PA, Grimont F, Efstratiou A, De Zoysa A, Mazurova I, Ruckly C, Lejay-Collin M, Martin-Delautre S, Regnault B; European Laboratory Working Group on Diphtheria. International nomenclature for Corynebacterium diphtheriae ribotypes. Res Microbiol. 2004;155: 162-6.
- Mikhailovich, V., M., Melnikov, V., G., Mazurova, I., K., Wachsmuth, I., K., Wenger, J., D., Wharton, M.,Nakao, H., Popovic, T. Application of PCR for detection of toxigenic Corynebacterium diphtheriae strains isolated during the Russian diphtheria epidemic. J Clin Microbiol. 1995;33:3061-3063.
- Nakao, H., Popovic, T. Development of a direct PCR assay for detection of the diphtheria toxin gene. J Clin Microbiol. 1997;35:1651-1655.
- Pallen MJ, Hay AJ, Puckey LH, Efstratiou A. Polymerase chain reaction for screening clinical isolates of corynebacteria for the production of diphtheria toxin. J Clin Pathol. 1994; 47:353-6.
- Grimont PA et al., and the European Laboratory Working Group on Diphtheria.International nomenclature for Corynebacterium diphtheriae ribotypes Res Microbiol. 2004 Apr;155(3):162-6.