Skillnad mellan versioner av "Trypanosoma brucei"
| (31 mellanliggande sidversioner av 2 användare visas inte) | |||
| Rad 1: | Rad 1: | ||
| − | '''Huvudartikel publicerad augusti 2011. | + | '''Huvudartikel''', publicerad augusti 2011. |
------ | ------ | ||
Till innehållsförteckning för [[Referensmetodik:Parasitologisk diagnostik]] | Till innehållsförteckning för [[Referensmetodik:Parasitologisk diagnostik]] | ||
| Rad 7: | Rad 7: | ||
--------- | --------- | ||
==''Trypanosoma brucei gambiense'', och ''T.b. rhodesiense''- afrikansk trypanosomiasis, sömnsjuka== | ==''Trypanosoma brucei gambiense'', och ''T.b. rhodesiense''- afrikansk trypanosomiasis, sömnsjuka== | ||
| + | |||
===Smittämne=== | ===Smittämne=== | ||
| − | |||
| − | + | Afrikansk sömnsjuka hos människor orsakas av två underarter av en flagellat – ''Trypanosoma brucei''. Infektionen uppträder i olika former och indelas vanligen i västafrikansk (orsakad av ''T. brucei gambiense'') och östafrikansk (orsakad av ''T. brucei rhodesiense'') trypanosomiasis. ''T. brucei rhodesiense'' är placerad i riskklass 3** av Arbetsmiljöverket (AFS 2005:1). Infektionen sprids med tsetseflugan (''Glossina''). | |
| − | Afrikansk sömnsjuka hos människor orsakas av två underarter av en | ||
===Livscykel=== | ===Livscykel=== | ||
| − | ''T. brucei'' förekommer i | + | ''T. brucei'' förekommer i form av extraacellulära trypomastigoter i blod, lymfa och cerebrospinalvätska hos infekterade människor eller reservoardjur. Tsetseflugan får i sig trypomastigoter när den biter för ett blodmål. Trypomastigoter replikerar i insektens tarmkanal och migrerar till salivkörtlarna där de utvecklas till metacykliska former som är invasiva för människor eller djur. Vid nästa flugbett överförs de invasiva formerna till såret och parasiten utvecklas sedan extracellulärt i blodet till trypomastigoter. Parasiterna delar sig och invaderar så småningom lymfkörtlar och CNS. |
===Symtom och klinisk bild=== | ===Symtom och klinisk bild=== | ||
| − | + | Vid insektsbettet kan utvecklas ett svullet sår (chancre). De tidiga symtomen kan bestå av huvudvärk, yrsel, trötthet, muskelvärk och aptitlöshet. Senare tillkommer feber, svullnad av lymfkörtlar, lever och mjälte, nervsmärtor och hjärninflammation. CNS-symtom som apati och personlighetsförändringar kan ses inom en månad efter infektion. Vid den östafrikanska formen har sjukdomen ett akut förlopp och obehandlade patienter avlider ofta inom ett år, ibland mycket snabbare. Sjukdomsbilden vid den västafrikanska formen är kronisk och CNS-symtom kan ses först efter 6–12 månader efter infektionen. | |
| − | ===Epidemiologi=== | + | ===Epidemiologi=== |
| − | + | ||
| − | Afrikansk sömnsjuka räknas som tredje viktigaste parasitsjukdomen i världen. | + | Afrikansk sömnsjuka räknas som den tredje viktigaste parasitsjukdomen i världen. Sextio miljoner människor i 37 länder söder om Sahara löper risk att bli smittade och 300 000 nya fall per år beräknas. Infektionen är kraftigt underrapporterad och WHO beräknar att tillförlitlig data finns för knappt 10 % av exponerade människor i endemiska områden. Parasiten orsakar också stora ekonomiska förluster genom att infektera och döda nötkreatur i Östafrika. Människa är huvudsaklig reservoar för ''T. brucei gambiense'' som orsakar kronisk sjukdom. Över 90 % av alla rapporterade fall från endemiska områden avser infektioner med ''T. brucei gambiense''. Nötkreatur, samt vissa vilda djur, är reservoarer för ''T. brucei rhodesiense'', som orsakar akut infektion. Denna form av trypanosomiasis anses vara en zoonos, d.v.s. sjukdom som sprids från djur till människa. Mindre än 10 % av rapporterade fall avser infektioner med ''T. brucei rhodesiense''. |
| − | Inkubationstiden vid infektion med östafrikanska formen är kort | + | I icke endemiska länder är däremot proportionen av infektion med ''T. brucei rhodesiense'' och ''T. brucei gambiense'' inverterad: cirka 95 % av de importerade fallen är infektioner med ''T. brucei rhodesiense''. |
| − | + | ||
| − | + | Inkubationstiden vid infektion med den östafrikanska formen är kort (mellan tre dygn och tre veckor). Vid infektion med den västafrikanska formen är den betydligt längre, från några månader upp till ett år. Kongenitalsmitta och smitta via blodtransfusion är möjlig. | |
| − | + | ||
| − | *EDTA- eller kapillärblod | + | I mycket sällsynta fall kan djur-trypanosomer som ''T. evansi'' och ''T. congolense'' (parasit hos boskap, häst, får, get och kamel) samt ''T. lewisi'' (parasit hos gnagare) infektera människa. Infektioner har rapporterats från Elfenbenskusten (''T. congolense''), Egypten, Indien, Malaysia (''T. evansi'') och Thailand (''T. lewisi''). Parasiter sprids från djur till människor med blodsugande stallflugor. |
| − | *Lymfkörtelaspirat | + | |
| − | *Cerebrospinalvätska | + | ==Provtagning och transport== |
| − | *Serum, tas | + | |
| − | + | ===Provmaterial=== | |
| − | Se [[provtagningsföreskrifter]] | + | |
| + | *EDTA- eller kapillärblod (mikroskopi) | ||
| + | *Lymfkörtelaspirat (mikroskopi) | ||
| + | *Cerebrospinalvätska (mikroskopi) | ||
| + | *Serum (för antikroppspåvisning), tas tidigast 2 veckor efter misstänkt infektion | ||
| + | ===Provtagning=== | ||
| + | |||
| + | Se [[Provtagning och transport|provtagningsföreskrifter]] | ||
==Laboratoriediagnostik== | ==Laboratoriediagnostik== | ||
| − | |||
| − | |||
===Allmänt=== | ===Allmänt=== | ||
| − | Mikroskopisk påvisning av trypomastigoter i blod och lymfkörtelaspirat är lämplig för | + | |
| + | Mikroskopisk påvisning av trypomastigoter i inokulationssår (hud chancre), blod och lymfkörtelaspirat är enbart lämplig för det tidiga stadiet av infektionen; parasiter i cerebrospinalvätska påvisas först vid uppkomst av CNS-symtom. Antal parasiter i provmaterialet varierar och är störst under feberperioder. Patienter som är infekterade med ''T. brucei gambiense'' har färre parasiter i blod jämfört med patienter som är infekterade med ''T. brucei rhodesiense''. Negativt fynd utesluter inte ''T. brucei''-infektion. Upprepade provtagningar kan vara nödvändiga på grund av intermittent parasitemi. Mikroskopi tillåter inte differentiering av underarter. | ||
| + | Vid hantering av patientmaterial beaktas skyddsåtgärder lämpliga för blodsmitta eftersom levande trypomastigoter är mycket invasiva. ''T. brucei rhodesiense'' är placerad i riskklass 3** av Arbetsmiljöverket (AFS 2005:1), vilket innebär att parasiten inte är luftburen men infektion genom kontaminerat blod orsakar en allvarlig sjukdom med begränsade behandlingsmöjligheter. | ||
| + | |||
===Referensmetodik=== | ===Referensmetodik=== | ||
| − | Mikroskopisk påvisning av trypomastigoter i tjock droppe och/eller i tunt utstryk från blod, lymfkörtelaspirat eller cerebrospinalvätska efter [[ | + | |
| + | Mikroskopisk påvisning av trypomastigoter i tjock droppe och/eller i tunt utstryk från blod, lymfkörtelaspirat eller cerebrospinalvätska efter Giemsafärgning ([[PAR 09 Malariamikroskopi|PAR 09]]). Undersökning av flera tjocka droppar rekommenderas för att öka känsligheten, | ||
| + | |||
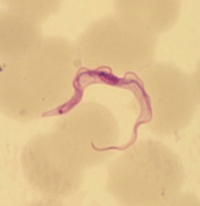
| + | [[Fil:TrypbruceiBS-a.jpg|thumb|200px|right| Trypomastigot av ''T. brucei'', Giemsa-färgat blodutstryk. ''Foto: Silvia Botero Kleiven, Smittskyddsinstitutet.'']] | ||
| + | |||
====Avläsningskriterier==== | ====Avläsningskriterier==== | ||
| − | Trypomastigoter av ''T. brucei'' är avlånga, ca 30 µm x 1,5 - 3,5 µm | + | |
| + | Trypomastigoter av ''T. brucei'' är avlånga, ca 30 µm x 1,5 - 3,5 µm och har ett vågigt membran längs med kroppen samt en fri flagell i främre änden. Den centralt placerade kärnan samt kinetoplasten i den bakre änden färgas violetta med Giemsafärg medan cytoplasman färgas blå. | ||
====Kvalitetssäkring==== | ====Kvalitetssäkring==== | ||
| − | ''T. brucei''-trypomastigoter i blodutstryk ingår i UK-NEQAS utskick. | + | |
| + | ''T. brucei''-trypomastigoter i blodutstryk ingår i UK-NEQAS utskick. | ||
| + | Ett internationellt referenslaboratorium för ''T. brucei''-diagnostik i människor och djur finns vid Tropik Institutet i Antwerpen, Holland (WHO Collaborating Centre for Research and Training of Sleeping Sickness Diagnosis). | ||
====Svarsrutiner==== | ====Svarsrutiner==== | ||
| − | |||
| − | Inga | + | Trypomastigoter av ''Trypanosoma brucei'' subspecies påvisade |
| + | |||
| + | Inga trypomastigoter påvisade. | ||
| + | |||
===Övriga diagnostiska metoder=== | ===Övriga diagnostiska metoder=== | ||
| − | *Mikrohematokritmetod för mikroskopisk påvisning av trypomastigoter | + | |
| − | + | ====Direkt påvisning==== | |
| − | + | ||
| − | *CATT | + | *Direkt undersökning av kapillärblod, lymfkörtelaspirat, cerebrospinalvätska för rörliga trypomastigoter är en snabb och högt specifik diagnostisk metod men den kan uppvisa en lägre känslighet vid fall av ''T. brucei gambiense'' infektion. Undersökningen skall endast utföras på nytaget material. |
| − | * | + | |
| + | *Det finns olika koncentrationsmetoder som visar en bättre känslighet än undersökning av Giemsafärgad tjockdroppe; dessa metoder kräver dock centrifugeringssteg och/eller annan speciell utrustning. Observera att risk för stickskador föreligger vid hantering av objektglas eller kapillärrör! | ||
| + | # Mikrohematokritmetod för mikroskopisk påvisning av rörliga trypomastigoter. | ||
| + | # QBC (quantitative buffy-coat), en koncentrationsmetod för påvisning av trypomastigoter i blod med hjälp av kapillärrör impregnerade med akridinorange samt fluorescensmikroskop. | ||
| + | # Minianion exchange centrifugation technique (mAECT) som renar fram trypomastigoter från blodceller genom kromatografisk separation, testen utförs endast vid några specialiserade laboratorier (se kvalitetssäkring). | ||
| + | *PCR-baserade metoder för påvisning av parasit-DNA och identifiering av underarter är endast tillgängliga vid några referenslaboratorier. | ||
| + | |||
| + | ====Indirektpåvisning==== | ||
| + | *Antikroppsvaret mot ''T. brucei'' kan påvisas 3-4 veckor efter smittan. Antikroppssvaret mot ''T. brucei rhodesiense'' kan vara dåligt utvecklat eftersom sjukdomen oftast har ett hastigt förlopp. Serologiska metoder för påvisning av antikroppar mot ''T. brucei'' som IFL och ELISA tillåter inte differentiering av underarter. | ||
| + | *CATT (card agglutination test) och LATEX-agglutinationstest är tillgängliga för diagnos av infektion med ''T. brucei gambiense'' . Testerna används för undersökning av antikroppssvar hos människor främst i endemiska områden. | ||
| + | *Förhöjt total-IgM i blod och i cerebrospinalvätska kan vara indikativt för ''Trypanosoma brucei''-infektion. | ||
===Laboratorierapportering=== | ===Laboratorierapportering=== | ||
| − | Infektion med ''Trypanosoma brucei'' är inte anmälningspliktig. | + | |
| + | Infektion med ''Trypanosoma brucei'' subspecies är inte anmälningspliktig enligt smittskyddslagen. | ||
| + | |||
==Litteraturhänvisningar== | ==Litteraturhänvisningar== | ||
| − | *Control and surveillance of African trypanosomiasis Report of a WHO Expert Committee; 1995 Geneva, Switzerland | + | |
| − | *Maudlin I. African trypanosomiasis | + | *Control and surveillance of African trypanosomiasis Report of a WHO Expert Committee; 1995 Geneva, Switzerland |
| + | *Chappuis F, Loutan L, Simarro P, Lejon V, Buscher P. Options for Field Diagnosis of Human African Trypanosomiasis. Clin Microbiol Rev. 2005; 18(1): 133-146. | ||
| + | *Maudlin I. African trypanosomiasis. Ann. Trop. Med. Parasitol. 2006;100(8):670-701. | ||
| + | *Malvy D., Chappuis F. Sleeping sickness. Clin Microbiol Infect. 2011; 17(7):986-95. | ||
| + | *Wastling SL., Welburn SC. Diagnosis of human sleeping sickness: sense and sensitivity. Trends Parasitol. 2011; 27(9):394-402. | ||
| + | *Simarro PP, Franco JR, Cecchi G, Paone M, Diarra A, Ruiz Postigo JA, JanninJG. Human African trypanosomiasis in non-endemic countries (2000-2010). J Travel Med. 2012 Jan-Feb;19(1):44-53. | ||
| + | *Migchelsen SJ, Büscher P, Hoepelman AI, Schallig HD, Adams ER. Human Africantrypanosomiasis: a review of non-endemic cases in the past 20 years. Int J Infect Dis. 2011 Aug;15(8):e517-24. | ||
| + | |||
| + | |||
--------- | --------- | ||
[[Kategori:Parasiter]] | [[Kategori:Parasiter]] | ||
Nuvarande version från 2 oktober 2012 kl. 12.32
Huvudartikel, publicerad augusti 2011.
Till innehållsförteckning för Referensmetodik:Parasitologisk diagnostik
se även Infektioner i centrala nervsystemet
Trypanosoma brucei gambiense, och T.b. rhodesiense- afrikansk trypanosomiasis, sömnsjuka[redigera]
Smittämne[redigera]
Afrikansk sömnsjuka hos människor orsakas av två underarter av en flagellat – Trypanosoma brucei. Infektionen uppträder i olika former och indelas vanligen i västafrikansk (orsakad av T. brucei gambiense) och östafrikansk (orsakad av T. brucei rhodesiense) trypanosomiasis. T. brucei rhodesiense är placerad i riskklass 3** av Arbetsmiljöverket (AFS 2005:1). Infektionen sprids med tsetseflugan (Glossina).
Livscykel[redigera]
T. brucei förekommer i form av extraacellulära trypomastigoter i blod, lymfa och cerebrospinalvätska hos infekterade människor eller reservoardjur. Tsetseflugan får i sig trypomastigoter när den biter för ett blodmål. Trypomastigoter replikerar i insektens tarmkanal och migrerar till salivkörtlarna där de utvecklas till metacykliska former som är invasiva för människor eller djur. Vid nästa flugbett överförs de invasiva formerna till såret och parasiten utvecklas sedan extracellulärt i blodet till trypomastigoter. Parasiterna delar sig och invaderar så småningom lymfkörtlar och CNS.
Symtom och klinisk bild[redigera]
Vid insektsbettet kan utvecklas ett svullet sår (chancre). De tidiga symtomen kan bestå av huvudvärk, yrsel, trötthet, muskelvärk och aptitlöshet. Senare tillkommer feber, svullnad av lymfkörtlar, lever och mjälte, nervsmärtor och hjärninflammation. CNS-symtom som apati och personlighetsförändringar kan ses inom en månad efter infektion. Vid den östafrikanska formen har sjukdomen ett akut förlopp och obehandlade patienter avlider ofta inom ett år, ibland mycket snabbare. Sjukdomsbilden vid den västafrikanska formen är kronisk och CNS-symtom kan ses först efter 6–12 månader efter infektionen.
Epidemiologi[redigera]
Afrikansk sömnsjuka räknas som den tredje viktigaste parasitsjukdomen i världen. Sextio miljoner människor i 37 länder söder om Sahara löper risk att bli smittade och 300 000 nya fall per år beräknas. Infektionen är kraftigt underrapporterad och WHO beräknar att tillförlitlig data finns för knappt 10 % av exponerade människor i endemiska områden. Parasiten orsakar också stora ekonomiska förluster genom att infektera och döda nötkreatur i Östafrika. Människa är huvudsaklig reservoar för T. brucei gambiense som orsakar kronisk sjukdom. Över 90 % av alla rapporterade fall från endemiska områden avser infektioner med T. brucei gambiense. Nötkreatur, samt vissa vilda djur, är reservoarer för T. brucei rhodesiense, som orsakar akut infektion. Denna form av trypanosomiasis anses vara en zoonos, d.v.s. sjukdom som sprids från djur till människa. Mindre än 10 % av rapporterade fall avser infektioner med T. brucei rhodesiense. I icke endemiska länder är däremot proportionen av infektion med T. brucei rhodesiense och T. brucei gambiense inverterad: cirka 95 % av de importerade fallen är infektioner med T. brucei rhodesiense.
Inkubationstiden vid infektion med den östafrikanska formen är kort (mellan tre dygn och tre veckor). Vid infektion med den västafrikanska formen är den betydligt längre, från några månader upp till ett år. Kongenitalsmitta och smitta via blodtransfusion är möjlig.
I mycket sällsynta fall kan djur-trypanosomer som T. evansi och T. congolense (parasit hos boskap, häst, får, get och kamel) samt T. lewisi (parasit hos gnagare) infektera människa. Infektioner har rapporterats från Elfenbenskusten (T. congolense), Egypten, Indien, Malaysia (T. evansi) och Thailand (T. lewisi). Parasiter sprids från djur till människor med blodsugande stallflugor.
Provtagning och transport[redigera]
Provmaterial[redigera]
- EDTA- eller kapillärblod (mikroskopi)
- Lymfkörtelaspirat (mikroskopi)
- Cerebrospinalvätska (mikroskopi)
- Serum (för antikroppspåvisning), tas tidigast 2 veckor efter misstänkt infektion
Provtagning[redigera]
Laboratoriediagnostik[redigera]
Allmänt[redigera]
Mikroskopisk påvisning av trypomastigoter i inokulationssår (hud chancre), blod och lymfkörtelaspirat är enbart lämplig för det tidiga stadiet av infektionen; parasiter i cerebrospinalvätska påvisas först vid uppkomst av CNS-symtom. Antal parasiter i provmaterialet varierar och är störst under feberperioder. Patienter som är infekterade med T. brucei gambiense har färre parasiter i blod jämfört med patienter som är infekterade med T. brucei rhodesiense. Negativt fynd utesluter inte T. brucei-infektion. Upprepade provtagningar kan vara nödvändiga på grund av intermittent parasitemi. Mikroskopi tillåter inte differentiering av underarter. Vid hantering av patientmaterial beaktas skyddsåtgärder lämpliga för blodsmitta eftersom levande trypomastigoter är mycket invasiva. T. brucei rhodesiense är placerad i riskklass 3** av Arbetsmiljöverket (AFS 2005:1), vilket innebär att parasiten inte är luftburen men infektion genom kontaminerat blod orsakar en allvarlig sjukdom med begränsade behandlingsmöjligheter.
Referensmetodik[redigera]
Mikroskopisk påvisning av trypomastigoter i tjock droppe och/eller i tunt utstryk från blod, lymfkörtelaspirat eller cerebrospinalvätska efter Giemsafärgning (PAR 09). Undersökning av flera tjocka droppar rekommenderas för att öka känsligheten,
Avläsningskriterier[redigera]
Trypomastigoter av T. brucei är avlånga, ca 30 µm x 1,5 - 3,5 µm och har ett vågigt membran längs med kroppen samt en fri flagell i främre änden. Den centralt placerade kärnan samt kinetoplasten i den bakre änden färgas violetta med Giemsafärg medan cytoplasman färgas blå.
Kvalitetssäkring[redigera]
T. brucei-trypomastigoter i blodutstryk ingår i UK-NEQAS utskick. Ett internationellt referenslaboratorium för T. brucei-diagnostik i människor och djur finns vid Tropik Institutet i Antwerpen, Holland (WHO Collaborating Centre for Research and Training of Sleeping Sickness Diagnosis).
Svarsrutiner[redigera]
Trypomastigoter av Trypanosoma brucei subspecies påvisade
Inga trypomastigoter påvisade.
Övriga diagnostiska metoder[redigera]
Direkt påvisning[redigera]
- Direkt undersökning av kapillärblod, lymfkörtelaspirat, cerebrospinalvätska för rörliga trypomastigoter är en snabb och högt specifik diagnostisk metod men den kan uppvisa en lägre känslighet vid fall av T. brucei gambiense infektion. Undersökningen skall endast utföras på nytaget material.
- Det finns olika koncentrationsmetoder som visar en bättre känslighet än undersökning av Giemsafärgad tjockdroppe; dessa metoder kräver dock centrifugeringssteg och/eller annan speciell utrustning. Observera att risk för stickskador föreligger vid hantering av objektglas eller kapillärrör!
- Mikrohematokritmetod för mikroskopisk påvisning av rörliga trypomastigoter.
- QBC (quantitative buffy-coat), en koncentrationsmetod för påvisning av trypomastigoter i blod med hjälp av kapillärrör impregnerade med akridinorange samt fluorescensmikroskop.
- Minianion exchange centrifugation technique (mAECT) som renar fram trypomastigoter från blodceller genom kromatografisk separation, testen utförs endast vid några specialiserade laboratorier (se kvalitetssäkring).
- PCR-baserade metoder för påvisning av parasit-DNA och identifiering av underarter är endast tillgängliga vid några referenslaboratorier.
Indirektpåvisning[redigera]
- Antikroppsvaret mot T. brucei kan påvisas 3-4 veckor efter smittan. Antikroppssvaret mot T. brucei rhodesiense kan vara dåligt utvecklat eftersom sjukdomen oftast har ett hastigt förlopp. Serologiska metoder för påvisning av antikroppar mot T. brucei som IFL och ELISA tillåter inte differentiering av underarter.
- CATT (card agglutination test) och LATEX-agglutinationstest är tillgängliga för diagnos av infektion med T. brucei gambiense . Testerna används för undersökning av antikroppssvar hos människor främst i endemiska områden.
- Förhöjt total-IgM i blod och i cerebrospinalvätska kan vara indikativt för Trypanosoma brucei-infektion.
Laboratorierapportering[redigera]
Infektion med Trypanosoma brucei subspecies är inte anmälningspliktig enligt smittskyddslagen.
Litteraturhänvisningar[redigera]
- Control and surveillance of African trypanosomiasis Report of a WHO Expert Committee; 1995 Geneva, Switzerland
- Chappuis F, Loutan L, Simarro P, Lejon V, Buscher P. Options for Field Diagnosis of Human African Trypanosomiasis. Clin Microbiol Rev. 2005; 18(1): 133-146.
- Maudlin I. African trypanosomiasis. Ann. Trop. Med. Parasitol. 2006;100(8):670-701.
- Malvy D., Chappuis F. Sleeping sickness. Clin Microbiol Infect. 2011; 17(7):986-95.
- Wastling SL., Welburn SC. Diagnosis of human sleeping sickness: sense and sensitivity. Trends Parasitol. 2011; 27(9):394-402.
- Simarro PP, Franco JR, Cecchi G, Paone M, Diarra A, Ruiz Postigo JA, JanninJG. Human African trypanosomiasis in non-endemic countries (2000-2010). J Travel Med. 2012 Jan-Feb;19(1):44-53.
- Migchelsen SJ, Büscher P, Hoepelman AI, Schallig HD, Adams ER. Human Africantrypanosomiasis: a review of non-endemic cases in the past 20 years. Int J Infect Dis. 2011 Aug;15(8):e517-24.