Provtagning och transport
Huvudartikel, reviderad juni 2012.
Till innehållsförteckngen för Referensmetodik:Parasitologisk diagnostik och Tarminfektioner
Transport och provtagningsföreskrifter vid parasitologisk undersökning[redigera]
Se också ”Provtagning och transport” i respektive kapitel.
1. Feces[redigera]
Parasitstadier[redigera]
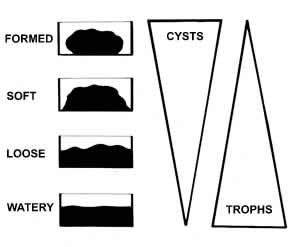
Vid intestinala parasitinfektioner kan olika utvecklingsstadier påvisas i feces. Maskägg, cystor och oocystor (som vanligen påvisas i koncentrationsprov) har vanligtvis bra hållbarhet under transport, oavsett om de är fixerade eller ej. Trofozoiter, som kan vara den dominerande formen vid E. histolytica- och G. intestinalis-infektion med kraftig diarré, kräver antingen att provet fixeras i anslutning till provtagningen eller att mikroskopin utförs snarast efter provtagning. Enligt figur 1. framgår att cyststadiet blir vanligare och trofozoiterna försvinner allteftersom avföringen blir fastare. Detta är av betydelse både för metodval och för eventuell fixering av feces.
Hållbarhet[redigera]
Generellt går det inte att ange exakta hållbarhetstider, men utbytet blir i vissa fall sämre med tiden, t.ex. vid koncentrering av Giardia-cystor. Därför rekommenderas ett snabbt omhändertagande även av fixerat provmaterial både för morfologi och för DNA-extraktion.
Antal prov[redigera]
Då många parasiter utsöndras intermittent rekommenderas upprepad provtagning vid kvarvarande kliniska besvär. Ett schema med anvisningar rörande val av undersökningsmetod, provmaterial och rekommenderat antal prov finns. Intag av koltabletter och röntgenkontrastmedel kan försvåra bedömningen av såväl fixerad som färsk feces och bör undvikas innan provtagning.
Val av transportmedium[redigera]
Formalin har traditionellt använts som transportmedium för fecesparasiter, men rekommenderas inte längre då det varken är lämpligt för trofozoitpåvisning eller PCR. För jämförelse av olika material och metoder se tabell. Då rutinerna kan variera mellan olika laboratorier bör man alltid ta reda på vilka föreskrifter som gäller lokalt.
Alternativ 1.[redigera]
SAF-fixativ (sodium acetate- acetic acid-formalin) rekommenderas som transportmedium för feces när mikroskopisk undersökning önskas. Alla utvecklingsstadier inklusive trofozoiter av Dientamoeba fragilis kan detekteras. Rekommenderas inte för PCR.
Alternativ 2.[redigera]
Obehandlad feces rekommenderas när man önskar utföra mikroskopi och PCR på samma material. "Färskprov" för påvisning av trofozoiter samt prov för isolering av Strongyloides -larver bör undersökas snarast möjligt efter provtagning.
OBS! En kombination av provtagningsalternativ 1 och 2 ger förutsättningar för optimal diagnostik. Etanolfixering rekommenderas för PCR-undersökning vid kraftig diarré med misstanke om förekomst av trofozoiter (främst Entamoeba histolytica). Observera att materialet är olämpligt för mikroskopi.
Provtagningsinstruktioner och transport[redigera]
Provtagningskärl med sked samt passande ytterhylsa används.
Feces uppsamlas från blöja eller ren toalettstol där man lagt flera lager av toalettpapper. Det är viktigt att avföringen inte blandas med urin eller vatten från toalettstolen. Vid mycket lös avföring är det bättre att använda ett engångskärl, t.ex. en pappersrondskål. En till tre skedar (mängden är beroende av provtagningskärl – se lokala anvisningar) feces, taget med skeden som sitter i locket, förs ned i provtagningskärlet. Om feces innehåller blodiga eller slemmiga partier tas prov även från dessa ställen. Om provtagningskärlet innehåller SAF eller etanol skall feces blandas mycket noggrant med fixativet. Locket skruvas till omsorgsfullt, varefter provtagningskärlet märks med namn, personnummer samt avsändare och provtagningsdatum. Därefter förs provtagningskärlet ned i ytterhylsan. Provet läggs i kuvert godkänt för posttransport av biologiskt material och sänds med vanlig postgång.
Observera att det är viktigt att patienten får tillgång till utförliga lokala provtagningsinstruktioner.
"Färskprov" för påvisning av trofozoiter samt prov för isolering av Strongyloides- larver bör undersökas snarast möjligt efter provtagning.
"Tejpprov" för påvisning av springmask – för provtagning se kapitel Enterobius vermicularis.
2. Urin för påvisning av Schistosoma-ägg[redigera]
Känsligheten av mikroskopisk påvisning av Schistosoma spp.-ägg ökar med provvolymen.
Urin bör uppsamlas dagtid under 4 timmar, lämpligen mellan klockan 10–14, då äggutsöndringen är störst. Det är även möjligt att undersöka en dygnsvolym urin.
OBS! Det är inte tillförlitligt att endast undersöka 10 mL urin då sensitiviteten blir låg. Vid negativt undersökningsresultat av ≤ 10 mL urin rekommenderas ny provtagning.
Förvaring och transport[redigera]
Urin samlas i ett rent kärl eller rör med tät förslutning. Undersökning av urinprov avseende Schistosoma-ägg bör utföras så snabbt som möjlig, helst samma dag som provet tagits. Om transporttiden förväntas överstiga 1 dygn kan man sätta till 1–2 mL 10 % formalin per 100 mL urin för att förhindra bakterietillväxt och kläckning av ägg. Provtagningsbehållare med urin läggs i ytterhylsa (rör) eller i en ask med tätt lock (större provtagningskärl) och packas för posttransport av biologiskt material. Provet sänds med vanlig postgång.
3. Prov för serologiska undersökningar[redigera]
Blod utan tillsatser, serum, plasma eller cerebrospinalvätska kan användas. Serum bör avskiljas innan transport. I allmänhet rekommenderas ett par mL serum utan tillsats men med modern teknik klarar man sig vanligen med betydligt mindre volymer.
Transport[redigera]
Provrör innehållande material för parasitologisk undersökning läggs i ytterhylsa samt kuvert godkänt för posttransport av biologiskt material och sänds med vanlig postgång.
4. Material för mikroskopisk påvisning av parasiter i blod och vävnad[redigera]
EDTA-blod i rör, tjock droppe och/eller blodutstryk på glas, imprint på glas från vävnadsbiopsi,utstryk från sår, ögonskrap, etc. Preparat på glas bör lufttorkas och packas i transporthylsa.
För specifika krav vid provtagning se ”Provtagning och transport” i respektive kapitel.
"Skin snip" för påvisning av O. volvulus – för provtagning se PAR 07
4.1.Blod och vävnadsprov för direkt påvisning av Leishmania[redigera]
Hudlesion[redigera]
Välj den lesion som är mest ”aktiv”. Tvätta först lesionen så kraftigt som det går med tvål och vatten för att få bort allt dött material, och för att exponera huden. Desinfektera sedan med 70 % alkohol. Om lokalanestesi skall göras injiceras så liten mängd som möjligt djupt under lesionen. Höga koncentrationer av lokalanalgetika kan ha hämmande effekt på parasit-tillväxten i odling. Om RPMI-transportmedium inte finns kan provmaterialet läggas i ett rör fyllt med steril fysiologisk koksaltlösning (0,9 % NaCl). Välj ett av nedanstående alternativ:
Med skalpell
Provmaterial tas sterilt från botten av såret samt från sårkanten. Överförmaterialet till RPMI-transportmedium. Flera hudbitar kan läggas i samma rör. Sist görs flera utstryk av materialet på objektglas.
Hudstans
Överför en hudstans sterilt till RPMI-transportmedium. Sist görs utstryk från material som skrapats med skalpell från botten av såret samt från sårkanten.
Finnålsbiopsi
Dra upp 0,1 mL steril fysiologisk koksaltlösning i en spruta och spruta in vätskan parallellt med sårkanten från utsidan. Rotera nålen flera gånger, aspirera vätskan och spruta ner i RPMI-transportmedium. Arbeta så sterilt som möjligt. Sist görs flera utstryk av materialet från nålen på objektglas.
Benmärg[redigera]
Material från benmärg överförs sterilt direkt i RPMI-transportmedium med tillsatt EDTA alternativt i ett EDTA-rör. Gör flera utstryk på objektglas med kvarvarande material i nålen.
Biopsi/aspirat från lever, mjälte, lymfkörtel eller annan vävnad[redigera]
Material överförs sterilt direkt i RPMI-transportmedium. Sist görs flera utstryk på objektglas. Om RPMI-transportmedium inte finns kan provmaterialet läggas i ett rör fyllt med steril fysiologisk koksaltlösning (0,9 % NaCl).
Förvaring och transport[redigera]
Utstryk på objektglas för mikroskopi:[redigera]
Låt torka och lägg därefter i transporthylsa. Förvaras i rumstemperatur.
Biopsimaterial för odling:[redigera]
Lägg provmaterial i RPMI-transportmedium(steril provtagning). Det är viktigt att materialet ej torkar in, fyll röret med medium. Förvaring i rumstemperatur i avvaktan på transport (vid behov, även över natt). Materialet får ej frysas.
EDTA-blod och benmärg i EDTA-rör för odling[redigera]
Förvaras i rumstemperatur i avvaktan på transport.
Material för PCR i fysiologisk koksaltlösning[redigera]
Förvaras i kylskåp i avvaktan på transport. Transporteras i rumstemperatur. På grund av risk för DNA-nedbrytning med nukleaser i organisk vävnad är det bättre ju kortare transporttiden är.
EDTA-blod och benmärg i EDTA-rör för PCR[redigera]
Förvaras i kylskåp i avvaktan på transport. Transporteras i rumstemperatur.
5. Prov för odling/anrikning[redigera]
Se "Provtagning och transport" i respektive kapitel.
6. Remiss[redigera]
Till provet som är märkt med personuppgifter bifogas en separat förpackad remiss med uppgifter om patientdata, avsändare, provtagningsdatum, provmaterial samt önskad undersökning. På remissen skall även anges utlandsresor, misstänkt infektionsdatum samt misstänkt smittkälla. Även preliminära resultat från avsändande laboratorium bör anges på remissen.