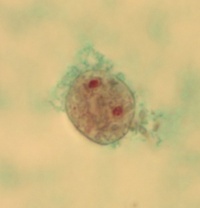
Dientamoeba fragilis
Huvudartikel, reviderad mars 2012.
Till innehållsförteckngen för Referensmetodik:Parasitologisk diagnostik och Tarminfektioner
Dientamoeba fragilis[redigera]
Smittämne[redigera]
Dientamoeba fragilis är en intestinal protozo som trots sitt amöbalika utseende räknas till flagellaterna. D. fragilis kännetecknas främst av att trofozoitstadiet har en eller två kärnor och att cyststadium saknas. Trots att D. fragilis upptäcktes redan 1909 är det först på senare år som denna parasit rönt global uppmärksamhet.
Livscykel[redigera]
Troligaste smittväg är fecal-oral smitta, något som dock inte är helt klarlagt, då känt cyststadium saknas och trofozoiten snabbt förstörs utanför kroppen. Transmission via infekterade ägg av Enterobius vermicularis (springmask) har också föreslagits, och kan möjligen vara en av flera smittvägar. Det enda djur där man tidigare med säkerhet har påvisat D. fragilis är gorilla. En nyligen publicerad studie (2012) visar att Dientamoeba är vanligt förekommande hos gris, varför zoonotisk transmission måste övervägas.
Symtom och klinisk bild[redigera]
D. fragilis återfinns i tjocktarmen där den kan orsaka låggradig ytlig irritation av tarmmukosan. Inga hållpunkter för invasiv förmåga har observerats. D. fragilis betraktas ofta som en harmlös parasit och många infektioner är asymtomatiska, men den har också förknippats med gastrointestinala symtom främst i form av diarré och magsmärtor. I många fall självläker infektionen inom ett par veckor men även långdragna besvär förekommer.
Epidemiologi[redigera]
Utbredningen är global och flera studier har visat att D. fragilis är en vanligt förekommande parasit, speciellt hos barn.
Provtagning och transport[redigera]
Provmaterial[redigera]
SAF-fixerad feces
Provtagning[redigera]
Laboratoriediagnostik[redigera]
Allmänt[redigera]
Diagnostik av D. fragilis-infektion har traditionellt skett genom mikroskopisk påvisning av trofozoitstadiet av organismen. Avsaknaden av cyststadium har lett till underdetektion av D. fragilis på de laboratorier där diagnostik av intestinala parasiter främst grundar sig på undersökning av koncentrerat fecesprov med avseende på cystor och maskägg. Screening för trofozoiter kan göras på filtrerat SAF-fixerat prov (lämpligen innan koncentrering) och därefter färgas suspekta fynd med t.ex. trikrom för fastställande av diagnos. Nyligen har flera artiklar publicerats som visar att realtids-PCR för D. fragilis har mycket större känslighet än morfologiska metoder och har föreslagits som referensmetodik. Molekylärbiologisk diagnostik av intestinala protozoer är dock tillsvidare förbehållet ett fåtal laboratorier.
Referensmetodik[redigera]
För diagnos av D. fragilis-infektion rekommenderas permanentfärgning (trikrom, hematoxylin, van Giesen) av SAF-fixerat fecesprov. Trofozoiterna degenererar snabbt utanför kroppen och feces måste blandas med SAF-fixativ så snabbt som möjligt efter provtagning. Formalinfixerad feces lämpar sig inte för permanentfärgning, då infärgningen inte blir optimal. Trikromfärgning av trofozoiter finns beskriven i PAR 03.
Morfologiska avläsningskriterier[redigera]
Cytoplasman hos D. fragilis-trofozoiterna framstår efter trikromfärgning som blekt grå-rosa och kärnorna klart röda. Varje kärna innehåller 4–8 kromatingranula och saknar synlig perifer kärnvägg. Ibland är kärnorna förbundna av en ”brygga”. D. fragilis är den enda intestinala amöba-liknande protozo där trofozoiterna kan ha antingen en eller två kärnor – vanligast två. Trofozoiterna varierar i storlek från 5 till 20 µm och det kan vara stora variationer i samma prov. Organismerna, som ofta ser asymmetriska ut, har vakuoliserad cytoplasman som innehåller bakterier.
Förväxlingsparasiter[redigera]
Trofozoiter av Endolimax nana, Iodamoeba butschlii, Chilomastix mesnili samt Blastocystis spp.
Kvalitetssäkring[redigera]
Giemsa-färgade preparat med D. fragilis-trofozoiter ingår i utskick från UK-NEQAS. SAF-fixerad feces med bland annat D. fragilis-trofozoiter ingår i utskick från CMPT Kanada.
Svarsrutiner[redigera]
Trofozoiter av Dientamoeba fragilis påvisade/ej påvisade. Positivt svar kompletteras med följande kommentar: Har i vissa fall associerats med gastrointestinala besvär, men dess patogena betydelse är ej fastställd.
Övriga diagnostiska metoder[redigera]
- Giemsafärgning
Ett tunt utstryk av ett färskt fecesprov, som metanolfixeras och Giemsafärgas har rekommenderats av UK-NEQAS som ersättningsmetod för trikrom- eller hematoxylinfärgning p. g. a. det enkla utförandet. Användningen är dock begränsad då färgningen anses svårtolkad.
- Färskprov
Mikroskopering av färskprov (nytaget fecesprov) används traditionellt för påvisning av rörliga amöba-trofozoiter. Svårigheten att identifiera D. fragilis-trofozoiter i ofärgat preparat begränsar dock värdet av färskprovs-undersökning när det gäller denna parasit.
- PCR
Både traditionell PCR och realtids-PCR finns beskrivna. SAF-fixerad feces lämpar sig sämre för PCR än färskt eller etanol-fixerat prov.
Laboratorierapportering[redigera]
Dientamoeba fragilis är inte anmälningspliktig enligt smittskyddslagen.
Litteraturhänvisningar[redigera]
- Cacciò SM, Sannella AR, Manuali E, Tosini F, Sensi M, Crotti D, Pozio E.Pigs as Natural Hosts of Dientamoeba fragilis Genotypes Found in Humans.EID Journal Ahead of Print/Volume 18, Number 5—May 2012.
- Barratt JL, Harkness J, Marriott D, Ellis JT, Stark D. A review of Dientamoeba fragilis carriage in humans: several reasons why this organism should be considered in the diagnosis of gastrointestinal illness. Gut Microbes. 2011 Jan-Feb;2(1):3-12. Review.
- Barratt JL, Harkness J, Marriott D, Ellis JT, Stark D. The ambiguous life of Dientamoeba fragilis: the need to investigate current hypotheses on transmission. Parasitology. 2011 Apr;138(5):557-72. Epub 2011 Feb 24. Review.
- Lindström J, Evengård B. Dientamoeba fragilis – gammal parasit med förnyad aktualitet. Smittskydd. 2000;11:119-121.
- Stark D, Barratt J, Roberts T, Marriott D, Harkness J, Ellis J. Comparison of microscopy, two xenic culture techniques, conventional and real- time PCR for the detection of Dientamoeba fragilis in clinical stool samples. Eur J Clin Microbiol Infect Dis. 2010 Apr;29(4):411-6.
- Verweij JJ, Mulder B, Poell B, van Middelkoop D, Brienen EA, van Lieshout L. Real-time PCR for the detection of Dientamoeba fragilis in fecal samples. Mol Cell Probes. 2007 Oct-Dec;21(5-6):400-4.