Skillnad mellan versioner av "CNS-infektioner kongenitalt"
| Rad 30: | Rad 30: | ||
| − | + | ---- | |
| − | + | *[[Fil:CNStabell2b.jpg]] | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
=== VIRUS === | === VIRUS === | ||
Versionen från 8 oktober 2009 kl. 10.42
Till innehållsförteckningen för Referensmetodik: Infektioner i centrala nervsystemet
CNS-INFEKTIONER. Kongenitala och under det första levnadsåret
Benägenheten för infektioner att invadera CNS är större under nyföddhetsperioden än senare i livet. Bristande förmåga hos ett omoget immunförsvar att bekämpa de agens som kan överföras under förlossning och vid amning är bidragande orsak. Vidare är barriärfunktionen hos CNS ännu inte helt utvecklad, och förmår därför inte utestänga mikrobiella agens i lika hög utsträckning som vid vuxen ålder.
Tidpunkten för smittöverföring är inte alltid möjlig att definiera. Vissa infektioner kan överföras redan under graviditeten, men ger inte symtom förrän efter förlossningen eller långt senare i livet. En gränsdragning mellan kongenital, perinatal och neonatal infektion blir ofta godtycklig. I detta stycke behandlas därför de vanligast förekommande CNS-infektionerna under det första levnadsåret.
Generella tecken på CNS-infektion under neonatalperioden är irritabilitet, kramper, hyporeflexi, abnormal Moro-reflex, oregelbunden andning samt en buktande fontanell. Likvor bör analyseras med avseende på celltal, glukos- och proteinhalt; vid tolkning bör man beakta att normalvärdena skiljer sig från dem som är relevanta för senare perioder i livet (jfr sid 65).
Proteinkoncentration kan liksom cellantal vara hög, medan en låg sockerhalt kan vara ett normalt fynd neonatalt. Påvisande av smittämnen är relativt lätt, då de vanligtvis förekommer i stor mängd.
Den diffusa kliniska bilden av meningit hos nyfödda gör att diagnostisk lumbalpunktion måste utföras på vida indikationer. Detta förklarar också varför de flesta insända likvorprov från nyfödda ger negativt utfall vid mikrobiologisk diagnostik.
BAKTERIER
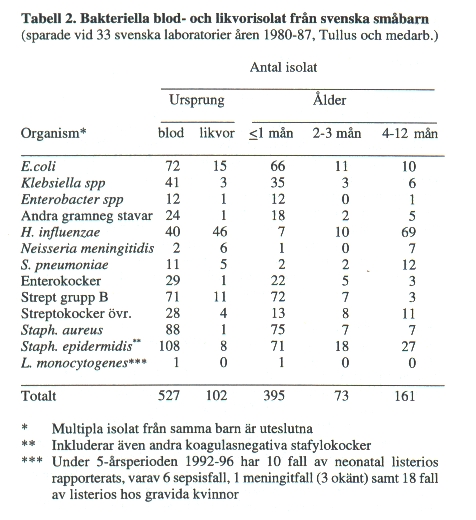
De flesta bakteriearter, som ger generaliserad infektion i nyföddhetsperioden kan också ge upphov till CNS-infektion. Högst risk för komplicerande CNS-infektion ses för E. coli och grupp B streptokocker (15-20%, Tabell 2).
Risken för bakteriemi liksom komplicerande neonatal meningit ökas med sjunkande födelsevikt (graviditetslängd) och därmed större omognad hos barnets immunförsvar. De flesta infektionsfallen äger rum under den första levnadsmånaden (ca 2 fall av 3, Tabell 2). Detta är typiskt särskilt för infektioner orsakade av enterobakterier och grupp B streptokocker (Tabell 2). De senare förekommer i vagina hos ca 15% av gravida och kan ibland ge intrauterin infektion eller infektion inom det första levnadsdygnet. En för tidig hinnbristning är vanlig, men någon gång sker spridning uppenbarligen via intakta hinnor.
Bakteriemi komplicerad med CNS-infektion hos barn i åldern 4-12 månader orsakas främst av H. influenzae, pneumokocker (Tabell 2) och meningokocker.
CNS-infektioner orsakade av stafylokocker (främst koagulasnegativa) är mindre vanliga och som regel komplikationer till neurokirurgiska ingrepp, vanligen shuntinsättning vid hydrocefalus.
Tidigt insatt antibiotikaterapi är avgörande för förloppet. Såväl i Sverige som internationellt anses nyare cefalosporiner (t ex cefotaxim) bäst kombinera god täckningsgrad av aktuella bakteriella patogener och tillräcklig penetration till likvor. För att täcka listeria och enterokocker kan tillägg av ampicillin i neonatalperioden övervägas. Dödligheten i neonatal bakteriell CNS-infektion är i storleksordningen 10 % och kan bero på för sent insatt terapi eller bakteriell resistens, t ex mutanter av Enterobacter cloacae och Listeria monocytogenes som är resistenta mot alla cefalosporiner. Därtill kommer risk för sekvele (hörselnedsättning, epilepsi, annat).
VIRUS
Herpes simplexvirus (HSV)
Herpes simplex virus typ 1 och 2 kan förorsaka livshotande infektioner under neonatalperioden. Troligen är transplacentär smittöverföring av HSV ovanlig, och neuronala skador av dessa neurotropa virus sällsynt förekommande under fosterlivet. HSV (i synnerhet HSV-2) överförs istället huvudsakligen perinatalt genom barnets kontakt med infekterade slemhinnor under passagen genom förlossningskanalen. En primär HSV-infektion hos mamman under sista trimestern är förenad med betydligt större risk för överföring av virus till barnet än reaktiverad infektion. Barriärskadande ingrepp som t.ex. övervakning med skalpelektrod eller anläggande av sugklocka medför ökad risk. Överföring av HSV till barnet har även beskrivits vid amning och vid primärinfektion med orala lesioner hos mamman. Aven andra familjemedlemmar kan smitta barnet om det saknar maternella antikroppar.
Den neonatala HSV-infektionen förekommer i tre former: disseminerad infektion, encefalit, samt kutan manifestation. De två förstnämnda kan orsakas av båda serotyperna, medan den kutana formen, som är förenad med god prognos, nästan enbart ses vid HSV-1 infektion.
Vid smitta efter primär HSV-infektion hos modern insjuknar barnet inom 10-12 dagar efter partus. Vid recidivinfektion kan inkubationstiden förlängas, till maximalt 6 veckor. Vid den disseminerade formen dominerar generella symtom som feber, irritabilitet eller slöhet, cyanos och apneattacker samt hepatosplenomegali. Vid encefalit dominerar kramper och opistotonus, slappa eller spastiska pareser, samt olika grader av medvetande- sänkning ned till korna. Blåsor ses endast hos hälften av barnen. Generellt har utfallet vid neonatal HSV framför allt typ 1-infektion förbättrats tack vare antiviral behandling med aciclovir. Tidigt insatt terapi är härvidlag av avgörande betydelse, varför en snabb och tillförlitlig diagnostik är nödvändig.
Beroende på HSV-serotyp är dock prognosen vid ren CNS-infektion fortfarande dålig även efter behandling. Få barn överlever utan neurologiska sekvele efter HSV-2-orsakad encefalit. Långtidsbehandling med aciclovir har prövats vid neonatal HSV-2-infektion med gott resultat i enstaka fall, men kontrollerade studier saknas. Inte minst med tanke på framtida terapiutvärdering är det av vikt att diagnostiken av neonatal HSV-infektion inkluderar serotypning av virus.
Varicella-Zostervirus (VZV)
Enstaka fall av kongenitalt överförd varicella-zostervirusinfektion har beskrivits i samband med varicella hos mamman under tidig graviditet. CNS-lesioner har uppkommit som följd av t.ex. ögonskador och kortikal atrofi med försämrad motorisk utveckling. Missbildningar av extremiteter ses. Mera fruktad är dock en sent (strax före förlossningen) överförd kongenital infektion, då barnet kan utveckla en disseminerad varicella med CNS -engagemang.
En kongenitalt överförd, neonatalt debuterande varicellainfektion kan förebyggas genom att ett exponerat barn behandlas med zoster-immunglobulin genast efter födelsen. Vid genombrott eller försummad profylax rekommenderas aciciovirbehandling av neonatal varicella.
Cytomegalovirus (CMV)
Cytomegalovirus har efter rubellavaccinationens allmänna genomförande framträtt som dominerande infektionsrelaterad orsak till kongenitala skador i vårt land med en beräknad årlig incidens av ca 80-100 skadade barn. Vid primär infektion hos mamman sker överföring i ca 40-50% av konstaterade primärfall. Även reaktiverad CMV hos mamman kan överföras till barnet. Eftersom reaktiverad CMV-infektion är betydligt vanligare änprimämnfektion är detta den vanligaste orsaken till smittöverföring. Overföring under tidig graviditet är möjligen förenad med svårare skador hos barnet. Vid sen infektion kan barnet födas helt utan sjukdomssymtom varefter eventuellt insjuknande sker under första levnadsveckorna
Allmänna symtom är intrauterin tillväxthämning, hepatosplenomegali med gulsot samt utslag med petekier. 1 svåra fall ses cerebrala förkalkningar periventrikulärt, och mikrocefalj med mental retardation. Ogonskador som korioretinit förekommer hos ca vart fjärde fall av svår kongenital CMV-infektion. Hörselskada är ett vanligt fynd, även hos barn som är asymtomatiska vid partus. Nyligen har förekomst av CMV- DNA i likvor neonatalt korrelerats till dålig prognos. Antiviral behandling med ganciklovir hr föreslagits och beskrivits i enstaka fall, mendet är ännu oklart om det har någon gynnsam effekt vid CMV-orsakad CNS-sjukdom.
Rubella
Rubellavirus har tidigare varit en framträdande orsak till fosterskador. Rubella uppträdde tidigare i omfattande epidemier på vårvintern, vart 6-7:e år. Ca 11-12% av gravida kvinnor var mottagliga för rubella men introduktionen av vaccination vid 18 månaders ålder har stoppat cirkulation av virus i Sverige och fall av kongenital rubella har ej rapporterats sedan 1985. Fortfarande bör dock rubelladiagnostik utföras på kvinna med akut exantemsjukdom under de 16 första graviditetsveckorna. Globalt är rubella fortfarande ett problem.
Då en gravid kvinna infekteras med rubella överförs virus till placenta under viremifasen, och virus kan infektera fostret. Då fostret infekteras påverkas cellutvecklingen, och under den känsliga anläggningsperioden sker skador på hjärt-kärlsystem, ögon och hörselorgan. Infektion av hjärnan är en allmän del i fosterinfektionen och ger ofta bestående skador. Överföringsrisken är nästan total under den 1:a graviditetsmånaden men sjunker till ca 10% under 16-20:e veckan. Den är därefter mycket låg fram till de sista veckorna före partus, då överföringsrisken ånyo stiger. Under första trimestern är skadefrekvensen ca 50% för att sedan sjunka till 5-10% vid infektion i 16:e veckan. Risk för svåra organskador och också hjänskada är störst vid infektion under de 10 första graviditetsveckorna. 1 olika uppföljningsmaterial är ca 40 % av kongenitalt rubellainfekterade barn mentalt retarderade, 7% autistiska och 80% har sensorioneuronala hörselskador. Bara 40 % når över IQ 90.
PARASITER
Kongenital toxoplasmos
Toxoplasmos orsakas av infektion med Toxoplasma gondii. Antikroppsprevalensen mot T. gondii hos gravida kvinnor är i södra Sverige ca 40%, i Stockholmsområdet 15 - 20% och i norra Sverige ca 12%. Efter genomgången primärinfektion betraktas personen som immun. Om gravid, ej immun, kvinna infekteras finns risk för kongenital infektion. Sannolikheten för infektionsöverföring ökar med graviditetstiden. Under första trimestern är sannolikheten för infektion av fostret ca 10%, medan den är ca 60% under tredje trimestern. Om infektionen sker under tidig graviditet är de vanligaste CNS-skadorna hydrocefalus och/eller mikrocefali, mental retardation, kramptillstånd och synnedsättning/blindhet. Det kongenitalt infekterade barnet kan ha allmänna symtom med feber, matningssvårigheter, ett ofta makulopapulöst utslag, leverpåverkan och lymfkörtelsvullnad. Infektion senare under graviditeten överförs ofta utan att ge symtom. Senare i livet kan dock korioretiniter med synnedsättning ev blindhet utvecklas (Se Referensmetodik - 1 7 Ögon- infektioner, sid 54).
Kongenital taxoplasmainfektion diagnostiseras med serologi.
Kongenital Chagas’ sjukdom
Trypanosoma cruzi, en flagellat, orsakar amerikansk trypanosomiasis (Chagas’ sjukdom). 1 Latinamerika är Chagas’ sjukdom ett stort hälso- problem och 12 - 18 miljoner beräknas vara infekterade. Infektionen överförs till människa av infekterade skinnbaggar (Triatoma spp). Kongenital transmission kan ske både under akut och kroniskt stadium av Chagas’ sjukdom. Infektionen kan orsaka abort, fosterdöd och prematur födsel. Vanliga fynd efter kongenital infektion är låg födelsevikt, myokardit och progressiva neurologiska förändringar. Mortaliteten är upp till 50%.
1 Sverige rekommenderas att barn till seropositiva mödrar ska följas parasitologiskt och serologiskt under första levnadsåret.
REFERENSER
Ahlfors K. Epidemiological studies of congenital cytomegalovirus jnfectjon. Akademisk avhandling. Malmö, 1982.
Forsgren M, Malm G. Herpes simplex virus and pregnancy. Scand J Infect Dis 1996; Suppi 100:14-19.
Hanshaw JB, Dudgeon JA, Marshall WC. Viral diseases of the fetus and newborn. Vol XVII Series Major Problems in Clinical Pediatncs. Saunders, Philadelphia, London, Toronto, 1985.
Sterner G editor. Guidelines for Management of Pregnant Women with Infections at Delivery and Care of their Newborns. Scand J Infect Dis 1990; Suppl 71.
Tullus K, Olsson-Liljequist B, Lundström G, Burman LG. Antibiotic Susceptibility of 629 Bacterial Blood and CSF Lsolates from Swedish Infants and the Therapeutic Implications. Acta Paediatr Scand 1991; 80: 205-212.