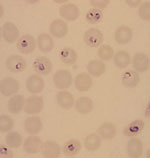
Plasmodium spp. (Malaria)
Huvudartikel publicerad juni 2011.
Till innehållsförteckningen för Referensmetodik:Parasitologisk diagnostik
och Referensmetodik: Infektioner i centrala nervsystemet
och Referensmetodik:Smittskyddslagens sjukdomar med Folkhälsomyndighetens falldefinition i artikeln Malaria
Plasmodium spp. - Malaria
Smittämne
Malaria orsakas av encelliga parasiter (protozoa) av släktet Plasmodium. Av över hundra kända Plasmodium-arter kan fem orsaka sjukdom hos människa: Plasmodium falciparum, P. vivax, P. ovale, P. malariae och P. knowlesi. Honmyggan från olika Anopheles-arter överför parasiten mellan människor och, i mindre utsträckning, mellan apor och människor.
Livscykel
Plasmodiernas livscykel karakteriseras av en sexuell fas (sporogoni) och en asexuell fas (schizogoni). Sporogonin sker i Anopheles-myggan efter att den sugit blod från en infekterad individ. Fertiliserade könsformer utvecklas till stavformiga stadier (sporozoiter) som vandrar till myggans spottkörtlar. Vid myggstick överförs sporozoiter till människa varefter schizogonin startar. Schizogonin innefattar exoerytrocytära faser och en erytrocytär fas av klinisk/diagnostisk relevans. Under den primära exoerytrocytära fasen söker sig sporozoiter från huden till levern och förökar sig i leverceller. Efter cirka en vecka (5-16 dagar) tränger merozoitstadier ut i cirkulationen och in i röda blodkroppar. Detta utgör starten för den erytrocytära fasen och symtomuppträdande. I den röda blodkroppen utvecklas merozoiten till olika former av diagnostisk relevans: tidiga ringformer ("signetringar"), trofozoiter och schizonter. Vid parasitutmognad och förökning lyseras de röda blodkropparna och nya blodkroppar infekteras. Livscykeln fullbordas när vissa merozoiter, som utvecklats till könsformer i röda blodkroppar (gametocyter), tas upp av myggan.
Specifika plasmodium-arter (P. vivax, P. ovale) kan under en sekundär exoerytrocytär fas bilda stadier som stannar kvar i levern (hypnozoiter) och reaktiveras långt efter den primära infektionen.
Symtom och klinisk bild
Inkubationstiden är i regel en till tre veckor. Huvudsymtomet är feber av oregelbunden karaktär eller med regelbundna intervall. Svår frossa och plötslig feber är det vanligaste symtomet, men ofta också illamående, kräkningar, huvudvärk, diarré, sjukdomskänsla och muskelvärk. Malaria kan ge mycket varierande klinisk bild beroende på vilka organsystem som är angripna. Sjukdomen bör därför misstänkas hos alla resenärer med feber hemkomna från endemiska områden. Bland svåra manifestationer av malaria ingår cerebral malaria, svår anemi, lungödem (ARDS), koagulatoriska och metabola rubbningar (främst acidos och hypoglykemi), njursvikt. Gravida kvinnor löper särskilt stor risk för allvarlig malaria och risk för graviditeten och låg födelsevikt.
Epidemiologi
Malaria är huvudsakligen endemisk i tropiska delar av Afrika, Asien och Sydamerika. Den geografiska förekomsten av malaria är komplex och regioner med stor malariabörda kan föreligga i närheten av områden med låg eller ingen endemicitet. Kombinationen av klimatologiska och geografiska faktorer tillsammans med socioekonomiska faktorer anses ofta vara avgörande för förekomsten av malaria.
WHO estimerar över 250 miljoner malariafall och cirka en miljon dödsfall per år, huvudsakligen i länder söder om Sahara (WHO). I endemiska områden drabbas framför allt barn under 5 års ålder och gravida kvinnor.
Humana Plasmodium-arter förekommer inte i Sverige idag. I Sydeuropa rapporteras enstaka endemiska fall årligen. Ett hundratal malariafall hos svenska resenärer rapporteras årligen enligt smittskyddslagen (SmiNet).
Provtagning och transport
Nytaget EDTA-blod (eller kapillärblod från fingerprick) för tjock droppe och utstryk på objektglas. EDTA-blod äldre än 6 timmar rekommenderas inte för mikroskopi. Heparinblod accepteras inte.
Generellt gäller snabbt omhändertagande. Primär malariadiagnostik är alltid att betrakta som akutprov.
Laboratoriediagnostik
Allmänt
Mikroskopisk påvisning och artbestämning av malariaplasmodier i tjock droppe och utstryk är fortfarande den rekommenderade metoden för att malariadiagnostik, då ingen annan metod är lika informativ och snabb. Med mikroskopi erhålls information om art, utvecklingsstadium, parasitemi samt ibland även förekomst av andra blodparasiter (t ex Trypanosoma). Se vidare under referensmetodik.
Referensmetodik
Mikroskopisk påvisning av malariaplasmodier efter Giemsafärging alternativt Field´s stain (PAR 09 ).
För bildmaterial se [1]
Epidemiologisk typning
Inte relevant
Kvalitetssäkring
Färgade utstryk och tjocka droppar ingår i UK-NEQAS utskick.
UK-NEQAS har även ett särskilt utskick för antigenpåvisning med ”snabbtest”
Svarsrutiner
Negativt prov
Inga malariaplasmodier påvisade.
Positivt prov
Malariaplasmodier påvisade. Ange species och utvecklingsstadium (d.v.s. skilj på sexuella och asexuella former).
- Ex 1: Ringformer av Plasmodium falciparum (ange parasitemi)
- Ex 2: Alla former av Plasmodium vivax
- Ex 3. Gametocyter av Plasmodium falciparum påvisade.
Om artbestämning inte är möjlig: Enstaka malariaplasmodier påvisade i tjock droppe. Artbestämning inte möjlig p. g. a. av låg parasitemi.
Observera att det morfologiskt inte går att skilja P. malariae från P. knowlesi. I förekommande fall (patienter från områden där båda species förekommer) skall detta framgå av svaret, samt att PCR rekommenderas för artbestämning. Se utsvarskommentarer.
Övriga diagnostiska metoder
Antigenpåvisning
Immunkromatografiska metoder kan användas för att enkelt och snabbt diagnostisera akut malaria när van laboratoriepersonal saknas, t ex på jourtid. Den kan också vara användbar för verifiering av P. falciparum infektion vid svårtolkad mikroskopi.
Metoderna bygger på detektion av cirkulerande Plasmodium-proteiner (antigen) i blod och refereras ofta till som snabbtest eller RDT (rapid diagnostic test). I Sverige används oftast Binax NOW Malaria Test som specifikt detekterar P. falciparum HRP-2 antigen samt aldolas-antigen (panmalaria-antigen) från alla Plasmodium-arter. En annan test; OptiMAL, bygger däremot på detektion av Plasmodium-LDH-antigen. Känsligheten för RDT är hög vid P. falciparum-infektion där detektionsgränsen är runt 0,002 % (100 parasiter/µL). Bra känslighet, >98 %, erhålls också vid P. vivax-infektion om parasitemin överstiger 0.02 % (1000 parasiter/µL). Känsligheten är generellt låg vid infektion med P. ovale och P. malariae. (De Monbrison et al, 2004). Falska positiva resultat kan förekomma vid kvarstående cirkulerande HRP-2 antigen (t.ex. efter behandling), vid förekomst av enbart gametocyter och, i vissa slags tester, vid förekomst av autoantikroppar. Falskt negativa resultat kan ses vid låga parasitemier och sekvensvariationer hos malaria-antigenet (Murray et al.2008).
Det är viktigt att både positiva och negativa resultat med snabbtester bekräftas med mikroskopi. Vid rapporterade fall av P. knowlesi-infektion har Binax NOW Malaria Test varit negativ (Bronner et al. 2009, Ta et al, 2010;) eller endast positiv med aldolase-antigenet. LDH-baserade tester verkar däremot fungera på ett tillfredställande sätt (van Hellemond et al, 2009).
Nukleinsyrapåvisning
Både konventionell, nestad och realtids-PCR finns beskrivna för detektion av olika Plasmodium species. Nestad PCR med artbestämning av P. falciparum, P. ovale P. vivax och P. malariae utförs för närvarande vid Karolinska Universitetssjukhuset i Solna. Det finns även metoder baserade på realtids PCR, men dessa är för närvarande inte uppsatta i Sverige. Med tanke på att en PCR-analys tar längre tid än mikroskopi och att informationen är begränsad till artbestämning rekommenderas inte PCR för akut malariadiagnostik. PCR rekommenderas istället för verifiering av artbestämning speciellt vid låg parasitemi eller då blandinfektion misstänks. Begränsning med nuvarande PCR-metodik förekommer. Det finns tex två genetiska varianter av P. ovale (Sutherland et al. 2010) och infektion med P. knowlesi kan förekomma. Det är därför viktigt att använda primrar som fångar upp alla Plasmodium-varianter.
PCR vid malariamisstanke med negativ mikroskopi har begränsat värde, istället rekommenderas i första hand upprepad provtagning för mikroskopi.
Serologi
Bestämning av antikroppar rekommenderas inte för primärdiagnostik av akut malaria. Antikroppspåvisning används för att konfirmera en diagnos i efterhand (t.ex. efter tropikvistelse då diagnos ställts lokalt), i seroepidemiologiska studier och i vissa fall för screening av blodgivare. Antikroppar kan påvisas under flera år hos personer från endemiska länder som utsatts för upprepade malariainfektioner. Hos patienter från icke endemiska områden brukar förhöjda IgG-antikroppstitrar ses tidigast en vecka efter symtom och sedan under minst 6 månader (Draper & Sirr 1980, Barreto-Miranda et al, 2008). Både indirekt immunfluorescens (IFL) och kommersiella ELISA tester finns beskrivna. Metoderna har likvärdig sensitivitet och specificitet för P. falciparum-infektion, men har varierande känslighet för infektioner med andra arter (She et al, 2007). Korsreaktioner kan också förekomma vid autoimmuna sjukdomar och mot andra parasiter.
Kvalitetssäkring av serologiska metoder
Det finns kvalitetsutskick för serologisk diagnostik från Instand e. V. (Tyskland).
Laboratorierapportering
Malaria är klassad som en sjukdom utöver allmänfarliga sjukdomar enligt Smittskyddslagen 2004-168 och är anmälningspliktig men inte smittspårningspliktig.
Litteraturhänvisningar
- Bronner U, Divis PC, Färnert A, Singh B. Swedish traveller with Plasmodium knowlesi malaria after visiting Malaysian Borneo. Malar J. 2009; 8:15.
- Draper CC, Sirr SS. Serological investigations in retrospective diagnosis of malaria. Br Med J. 1980; 280 (6231): 1575-6.
- van Hellemond JJ., Rutten M, Koelewijn R, Zeeman AM, Verweij JJ., Wismans PJ., Kocken CH., van Genderen PJJ. Human Plasmodium knowlesi Infection Detected by Rapid Diagnostic Tests for Malaria. EID.2009; 15 (9): 1478-1480.
- Miranda IB, Weber C, Fleischmann E, Bretzel G, Löscher T. Validity of malaria diagnosis in nonimmune travelers in endemic areas. J Travel Med. 2008; 15(6):426-31.
- De Monbrison F, Gérome P, Chaulet JF, Wallon M, Picot S, Peyron F. Comparative diagnostic performance of two commercial rapid tests for malaria in a non-endemic area. Eur J Clin Microbiol Infect Dis. 2004;23(10):784-6.
- Murray CK, Gasser RA Jr, Magill AJ, Miller RS. Update on rapid diagnostic testing for malaria. Clin Microbiol Rev. 2008;21(1):97-110.
- She RC., Rawlins ML., Ramsey Mohl BS , Perkins SL, Hill HR, Litwin CM. Comparison of Immunofluorescence Antibody Testing and Two Enzyme Immunoassays in the Serologic Diagnosis of Malaria.J Travel Med.2007;14 (2): 105–111
- Sutherland CJ, Tanomsing N, Nolder D, Oguike M, Jennison C, Pukrittayakamee S, Dolecek C, Hien TT, do Rosário VE, Arez AP, Pinto J, Michon P, Escalante AA, Nosten F, Burke M, Lee R, Blaze M, Otto TD, Barnwell JW, Pain A, Williams J, White NJ, Day NP, Snounou G, Lockhart PJ, Chiodini PL, Imwong M, Polley SD. Two nonrecombining sympatric forms of the human malaria parasite Plasmodium ovale occur globally. J Infect Dis. 2010 May 15;201(10):1544-50.
- Ta TT, Salas A, Ali-Tammam M, Martínez M del C, Lanza M, Arroyo E, Rubio JM. First case of detection of Plasmodium knowlesi in Spain by Real Time PCR in a traveller from Southeast Asia. Malar J. 2010; 9:219.
- World Malaria Report
- Referens PCR (Marianne)