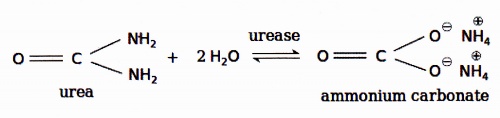Bilaga 1c. Biokemiska referenssubstrat för testbatteri vid identifiering av bakteriella tarmpatogener
Artikel publicerad april 2012. Innehållet preliminärt i väntan på konsensusförfarande
Till innehållsförteckningen för Referensmetodik: Tarminfektioner
Biokemiska referenssubstrat för identifiering av Salmonella, Shigella och Yersinia i rutindiagnostiken[redigera]
Allmänt[redigera]
Nedan beskrivna substrat kombineras till ett testbatteri lämpat för primär diagnostik av Salmonella, Shigella och Yersinia. Referenskombination för diagnostiken är Mannitolrör med Durhamrör, medier för påvisning av Lysindekarboxylas och H2S-produktion, Urea och ONPG/indol. Batteriet kan kompletteras med substrat för påvisande av ornitindekarboxylas (OD) som är användbart vid misstanke om Salmonella Typhi som bland Salmonellae är ensam att vara OD-negativ. Diagnosen Shigella sonnei stärks av påvisandet av OD-positivitet, övriga Shigellae är OD-negativa.
Medium med D-mannitol[redigera]
Medium för differentiering av arter inom Enterobacteriaceae som påvisar förmåga att degradera D-mannitol (en av sex naturligt förekommande sockeralkoholer med sex kolatomer) med eller utan gasutveckling.
Bakterier inom familjen kan utnyttja mannitol som kol-och energikälla. Mannitol internaliseras i bakteriecellerna och fosforyleras genom ett mikrobiellt fosfotransferassystem. Därefter sker en enzymatisk konvertering via ett dehydrogenas varvid molekylen omvandlas till D-fruktos under syrabildning. D-fruktos metaboliseras sedan vidare under avgivande av metabol energi. Vid processen bildar vissa mikroorganismer också gas, vilket kan studeras genom att i jäsningsröret applicera ett Durham-rör.
Typrecept medium med D-mannitol
| Innehåll | Mängd |
|---|---|
| BACTO Pepton | 10,0g |
| NaCl | 5,0g |
| di-Na-vätefosfat-dihydrat | 5,0g |
| Bromtymolblått 2g/kg | 12,0 mL |
| D-Mannitol Analytical Reagent | 5,0g |
Sätts till RO-vatten, 1000mL
pH justeras till 7,4+-0,2 och dispenseras i 3,5 mL glasrör med Durhamrör
Hållbarhet: 4 veckor i kyl
- Kontrollstammar
- Escherichia coli, CCUG 17620
- Proteus mirabilis, CCUG 26767
Lysindekarboxylas (LD)- och H2S-medier[redigera]
Medier för påvisande av lysindekarboxylasaktivitet och H2S-bildning hos bakterier tillhörande Enterobacteriaceae. Förekomst av både lysindekarboxylas och enzymsystem för att reducera tiosulfat eller sulfit till H2S (flera gener, phs, chlA, och menB, är involverade) är en framträdande egenskap hos många Salmonellae, men kan också förekomma hos andra bakteriearter.
Bakterier som producerar lysindekarboxylas dekarboxylerar aminosyran lysin i mediet under bildandet av basiska produkter (främst kadaverin). LD-buljongen antar då lila färg (beroende på vilken indikator som används). För bakterier som saknar LD förblir mediet surt (gulfärgat) beroende på bakteriernas metabolism. Kommersiella buljonger finns tillgängliga. Lysinet i mediet kan bytas mot ornitin för påvisande av ortnitindekarboxylas (OD).
Ett traditionellt referensmedium för påvisande av H2S-bildning hos bakterierna är kombinationsmediet Triple Sugar Iron (TSI)-agar som kan tillverkas som snedagar i buljongrör. Mediet innehåller glukos (såväl syrabildning som gasproduktion kan påvisas i botten av röret), laktos och sukros (färgar i förekommande fall hela mediet gult av bakteriemetabolism). Produktion av H2S genom reduktion av tiosulfat framträder som svärta i mediet. Kommersiella buljonger finns tillgängliga.
Kombinationsmedium (Lysindekarboxylas (LD)-buljong med järn-ammoniumsulfat och tiosulfat) kan användas för att påvisa samtidig förekomst av lysindekarboxylas-och sulfhydrasaktivitet hos Salmonella. Mediets pH höjs beroende på LD-aktiviteten, särskilt effektivt om reaktionen sker anaerobt (för att undvika pH-sänkning orsakad av bakteriens aeroba metabolism). Om bakterien samtidigt producerar vätesulfid (H2S) från tiosulfatet, kan detta reagera med järnet och bilda en svart, svårlöslig järnsulfid. Om bakterien inte producerar lysindekarboxylas sjunker mediets pH successivt beroende på glukosmetabolism och antar en gul färg. Mediet förblir då gult även om bakterierna har sulfhydrasaktivitet. Nedan visas recept för ett kombinationsmedium.
Kombinationsmedium för påvisning av LD-H2S
| Innehåll | Mängd |
|---|---|
| LD-buljong (kommersiell) | 14,0g |
| Agar-granulat | 6,0g |
| ammonium-järn(II)-sulfat-hexahydrat | 0,2g |
| Na-tiosulfat-pentahydrat | 0,2g |
| NaCl | 5,0g |
Sätts till RO-vatten, 1000mL
pH justeras till 6,1+-0,2 och dispenseras i 3,5 mL glasrör
Hållbarhet: 4 veckor i kyl
- Kontrollstammar
- Escherichia coli, CCUG 17620
- Proteus mirabilis, CCUG 26767
- Salmonella Typhimurium, CCUG 31969
Urea-buljong[redigera]
Medium för differentiering av gramnegativa stavar.
Vissa bakterier producerar enzymet ureas (bland andra Proteaee, Yersinia spp), vilket hydrolyserar urinämne under bildning av ammoniak och koldioxid. Ammoniak löser sig i mediet som blir basiskt varvid närvarande indikator (fenolftalein) slår om till rött.
Typrecept Urea-buljong
| Innehåll | Mängd |
|---|---|
| Pepton | 14,0g |
| Glukos | 6,0g |
| Di-natrium-fosfat | 0,2g |
| Kalium-dihydrogen-fosfat | 0,2g |
| NaCl | 5,0g |
| Fenolrött | 0,004g |
| Urea 40 % | 1 ampull (5 mL)/95, 0 mL medium |
Sätts till RO-vatten, 950mL
pH justeras till 6,8+-0,2 och dispenseras i 3,5 mL glasrör
Hållbarhet: 4 veckor i kyl
- Kontrollstammar
- Escherichia coli, CCUG 17620
- Proteus mirabilis, CCUG 26767
ONPG-Indol-medium[redigera]
Oto-nitrofenyl-β-galaktosid (ONPG) är en substans som kan användas för detektion av beta-galaktosidaseaktivitet hos bakterier. Enzymet hydrolyserar ONPG-molekylen till galaktos och orto-nitrofenol, den senare molekylen gulfärgar mediet. Beta-galaktosidas krävs för att bakterier ska kunna hydrolysera laktos som är det egentliga målsubstratet för enzymet. För att kunna hydrolysera laktos krävs att detta internaliseras i bakterierna, vilket sker via ett mikrobiellt permeas som finns hos många medlemmar av familjen Enterobacteriaceae. Dessa blir då i testsystem laktospositiva. Vissa bakterier saknar permeas och är då laktosnegativa, men kan ändå vara ONPG-positiva. Exempel är många stammar av Salmonella arizonae. De flesta övriga Salmonellae är såväl laktos som ONPG-negativa.
Till mediet kan också sättas aminosyran L-tryptofan som utnyttjas för påvisandet av indolproduktion. Positiv indoltest är klassisk för E. coli men förekommer även hos andra bakterier. Bakteriellt tryptofanas-enzym deaminerar tryptofan under bildande av indol, pyrodruvsyra och ammoniak. Indolet påvisas med en kemisk reaktion mellan indol och p-dimetylaminobenzaldehyd (ingrediens i Kovacs reagens som finns kommersiellt tillgänglig), varvid vid lågt pH ett rött färgämne, rosindol, bildas.
Typrecept ONPG-Idol-medium
| Innehåll | Mängd |
|---|---|
| 2-nitrofenol-beta-D-galaktopyranosid | 1,5g |
| di-natriumvätefosfat-dihydrat | 0,447g |
| neutraliserad bakteriologisk pepton | 7,5g |
| NaCl | 3,75g |
| L-tryptofan | 0,75g |
Sätts till RO-vatten, 1000mL
pH justeras till 7,4+-0,2 och dispenseras i 3,5 mL glasrör
Hållbarhet: 4 veckor i kyl
- Kontrollstammar
- Escherichia coli, CCUG 17620
- Proteus mirabilis, CCUG 26767
REFERENSER[redigera]
- Marie-Louise Danielsson-Tham. Några vanliga biokemiska tester inom bakteriologin. Andra reviderade upplagan. Publicerad 1985.
- Flera tillkommer...