Bilaga 2:Substratkontroll- Hud, mjukdelar, skelett och inre organ
Till innehållsförteckningen för Referensmetodik: Bakteriologisk diagnostik av infektioner i hud, mjukdelar, skelett och inre organ
Substratkontroll[redigera]
Ett stort antal olika generella, näringsberikade, selektiva, differentierande eller speciella media finns kommersiellt tillgängliga. Dessa är som regel noggrant specificerade och kvalitetskontrollerade av producenten, vilken på begäran bifogar analyscertifikat över aktuell lot. Detta innehåller uppgifter bl.a. om komposition, fysiologiska egenskaper, odlingsegenskaper med olika referensstammar, förvaring etc. enligt tillgängliga standarder, t.ex. NCCLS Doc M22-A. Trots detta föreligger skillnader mellan olika fabrikat; det kan exempelvis gälla den allmänna kompositionen av Columbia blodagarbas. Sådana skillnader kan ha betydelse för understödjande växt av olika bakteriearter men också påverka differentierande egenskaper som hemolys etc. Variationer förekommer också mellan olika tillverkningsloter (batcher) av samma substrat, större ju mer komplext substratet är. Vid det enskilda laboratoriet är sedan variationer vid den fortlöpande tillverkningen inom en och samma lot oundvikliga.
Testförfarande inför upphandling av fasta substrat, referensmetod[redigera]
Inför upphandling av generella näringsberikade substrat (blod-, hematin-, anaerob blodagar) skall dokumenterad jämförelse göras mellan pågående lot och prov från nya loter från en eller flera leverantörer. Loterna jämförs med avseende på allmänna växtkarakteristiska, såväl ”in vitro” med referensstammar som i det praktiska arbetet med kliniska prov. En av loterna väljs därefter. Det är därvid lämpligt att sprida renkulturer av föreslagna referensstammar slammade i PBS så att fria bedömbara kolonier erhålls. Alternativt används samma metod som för selektiva substrat (se nedan).
Upphandling av selektiva substrat (t.ex. MacConkeyagar) eller sådana avsedda för ”semikvantitativ” odling (CLED-agar) skall jämföras med lämplig uppsättning målbakterier (sådana som förväntas växa bra) och kontaminater (sådana som inhiberas). Vid sådan jämförelse rekommenderas samma metod som beskrivs i upplaga 2 av referensmetodik för infektioner i mag-tarmkanalen (SMI–tryck 141-2002). Även dessa substrat skall jämföras mot pågående lot i det praktiska arbetet med kliniska prov.
Testförfarande vid den fortlöpande tillverkningen av fasta substrat, referensmetod[redigera]
Den fortlöpande tillverkningskontrollen skall dokumenteras och följer principerna för lot-jämförelserna. Dock kan ett mindre batteri av testbakterier användas för granskning av vissa nyckelegenskaper hos respektive substrat. Även selektiva substrat kan därvid testas med granskning av renspridda kolonier.
Testförfarande vid upphandling och fortlöpande tillverkning av anrikningsbuljonger[redigera]
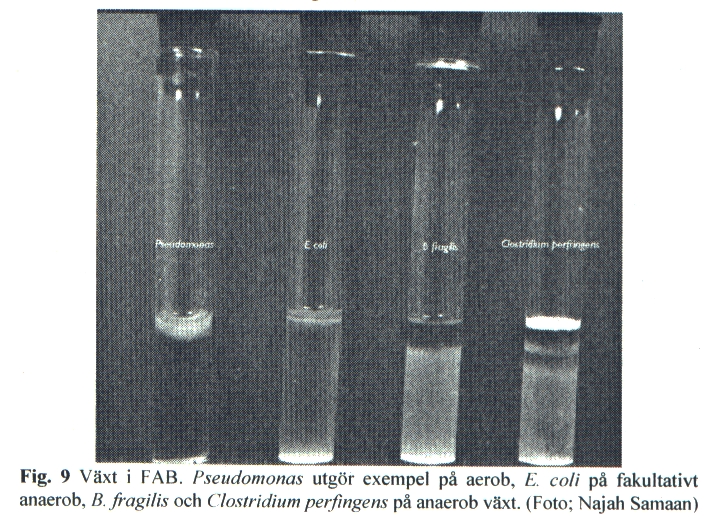
Vid testning av tioglykollat (FAB)-buljong är lämpligt urval av referensstammar B. fragilis CCUG 4856, Cl. perfringens CCUG 1795, F. nucleatum CCUG 32 898, P. aeruginosa CCUG 551, E. coli CCUG 17 620 och S. aureus CCUG 17621. Vid testningen inokuleras spädda kulturer av respektive bakteriestam i buljongen. För godkännande av batch krävs växt inom 24-72 timmar, den senare tidpunkten gäller fusobakterier, och typiskt växtsätt vid aerob inkubering indikerande god anaerobios på djupet och aerob miljö i ytskiktet. E. coli förväntas svärma i hela mediet.
- Metod
- 1. Färska övernattskulturer på agarplatta späds i aerob PBS till McFarland 0,5-1,0.
- 2. Stegvis spädning ned till ca CFU/10 μL ( CFU för fusobakterierna).
- 3. Inokulera rören (10 mL buljong i varje) med CFU i 10 μL plastinös som sticks ner mot botten. Mixa ej.
- 4. Sprid för insåddskontroll på lämpliga agarplattor, inkubera på lämpligt sätt.
- 5. Inkubera rören 24-72 timmar i 36 °C i luft.
- 6. Notera växt och växtsätt (se figur 9).
Aeroba buljonger (TSB med Fildes, GBS-buljong, VRE-buljong) skall kunna anrika små mängder av olika typer av mikroorganismer. Lämpligt urval för TSB med Fildes är S. pneumoniae CCUG 33774, S. pyogenes CCUG 33061, E. coli CCUG 17620, P. aeruginosa CCUG 551 och H. influenzae CCUG 33775. GBS-buljong och VRE-buljong testas med samma metod och kontrollstammar angivna under respektive recept.
- Metod:
- 1. Färska övernattskulturer späds i PBS till McFarland 0,5-1.
- 2. Stegvis spädning i 10-potenssteg ned till ca 10 CFU/10 μL PBS.
- 3. Tillsätt till rören (5 mL buljong i varje) CFU och CFU i 10 μL PBS, respektive.
- 4. Sprid för insåddskontroll på lämpliga agarplattor.
- 5. Inkubera övernatt i 36 °C i luft och sprid därefter 10 μL från varje rör på lämpliga agarplattor.
- 6. Resultatet bedöms acceptabelt om anrikning skett i något av rören för varje mikroorganism.