Hepatit B virus
Artikeln uppdaterad april 2012
Till innehållsförteckningen för Referensmetodik:Smittskyddslagens sjukdomar
och
falldefinition Hepatit B, falldefinition
Hepatit B (B16, B18.1)[redigera]
Etiologi[redigera]
Hepatit B-virus (HBV), elementkod MSHD006515.
Smittämnet[redigera]
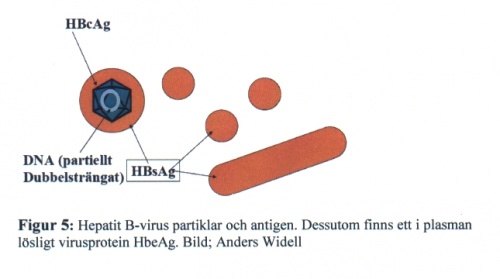
HBV är ett höljeförsett DNA-virus i familjen Hepadnaviridae. HBV går inte att odla in vitro. Viruspartikeln, Danepartikeln, består av ett delvis dubbelsträngat DNA, omslutet av en nukleokapsid, kallad hepatit B core-antigen (HBcAg) mot vilket antikroppar (anti-HBc) uppkommer tidigt under en infektion och kvarstår livslångt. Nukleokapsiden är innesluten i ett hölje med proteinet HBsAg. Dessutom produceras HBsAg i stort överskott i form av ”subviral particles” utan DNA-innehåll (figur 5). Ytterligare ett virusprotein, HBeAg, utsöndras till blodet, och kan där påvisas, vilket har betydelse för stadiebedömning och bedömning av smittsamhet.
Patogenes[redigera]
HBV infekterar hepatocyter men är i sig inte cytolytiskt. Leverskadan uppkommer som ett resultat av den inflammation som immunsvaret aktiverar. Inflammationen kan vid kronisk infektion efterlämna fibros som om den blir uttalad kan övergå i cirros.
Kronisk HBV-infektion innebär också en påtaglig risk för primär levercancer. Risken för cancer anses bland annat bero på att HBV-DNA integreras värdcellens DNA och att HBV kodar för ett protein (X-proteinet) som har transaktiverande effekter på många gener. Cancerutveckling är dock ovanlig i frånvaro av inflammation (levercellsomsättning) och ses nästan uteslutande hos patienter med cirros eller uttalad fibros.
Hög HBV-DNA-nivå i blodet är den viktigaste riskfaktorn för cirros eller cancer, men även genotypen har betydelse (störst risk för komplikation ses vid genotyp C-infektion).
Klinik[redigera]
Akut hepatit[redigera]
Om HBV-infektion förvärvas i vuxen ålder ses ofta kliniska symtom och påverkan på blodprover som förklaras av akut inflammation av levern. De flesta av dessa fall (>95 %) läker spontant ut. Symtomen är först ospecifika prodromalsymtom i form av trötthet, matleda, ledvärk som uppkommer efter en lång inkubationsfas med tilltagande viremi, och först 3-6 månader efter smittotillfället visar sig specifika symtom i form av kittfärgad feces, mörk urin, klåda, och gulsot (ikterus). I de flesta fall är immunsvaret effektivt och leder att kraftig suppression av virus och immunitet mot förnyad smitta utvecklas.
Virus finns vanligen kvar i levern som en latent infektion och ibland kan låggradig replikation fortsätta även om HBsAg i serum inte kan påvisas. Latent infektion har i regel ingen klinisk betydelse men kan reaktiveras vid immunsuppression och den mycket låga viruskoncentration kan innebära en risk för smitta med blod eller vid organtransplantation.
I sällsynta fall är immunsvaret alltför kraftigt vilket leder till mycket uttalad leverinflammation som kan resultera i sviktande leverfunktion, s.k. fulminant hepatit. Omvänt ger HBV-infektionen i många fall, särskilt hos barn, inga eller milda symtom och förlöper subkliniskt. En stor del av jordens befolkning,framför allt Asien och Afrika, har därför genomgått hepatit B-infektion utan att veta om det.
Kronisk hepatit[redigera]
Om immunsvaret är ineffektivt läker HBV-infektion inte spontant utan blir kronisk, vilket är vanligt i barndomen och ses hos 90 % vid perinatalt förvärvad infektion. Man brukar sätta gränsen för kronisk HBV-infektion när HBsAg-positivitet kvarstått mer än 6 månader. De flesta fall av kronisk infektion i Sverige har förvärvats i barndomen i länder med hög HBV-prevalens, och en mindre andel följer efter akut hepatit i vuxen ålder. Kronisk infektion som förvärvas i barndomen följer vanligen tre stadier. I det första är HBV-DNA-nivån i blodet mycket hög, och leverinflammation frånvarande (”tolerans”). Detta stadium följs av ett immmunaktivt stadium då immunsvaret blir mer aktivt, vilket i ogynnsamma fall kan leda till progressiv leverskada, med risk för cirros eller levercancer. I de flesta fall leder immunsvaret till sjunkande virusnivåer i blodet, och övergår i en lågaktiv övervakningsfas med ganska låga nivåer av HBV-DNA i serum.
Behandling[redigera]
Behandling kan ges som injektioner med pegylerat interferon under 6-12 månader eller som oral långtidsbehandling nukleosidanaloger (tenefovir, entecavir, lamivudin) enligt rekommendationer angivna på Läkemedelsverkets hemsida.
Epidemiologi[redigera]
Totala antalet kroniska bärare av HBV i världen har uppskattats till 360 miljoner medan kanske 6 gånger fler har läkt infektionen. Frekvensen av kroniska HBV-infektion skiljer sig mycket i olika världsdelar. Den lägsta frekvensen, < 0,5 % föreligger i Nordamerika och Västeuropa, medan den högsta 6 – 20 % ses i Afrika och Sydostasien.
HBV kan överföras sexuellt, som mor-barnsmitta vid födseln samt via blodprodukter och annan blodkontakt. Fram till ca 1970 var transfusionssmitta vanlig, men har i stort sett eliminerats i länder med välfungerande testning av blodgivare.
Nosokomial spridning förekommer inom dialys och hemofilivård och är ett stort problem globalt eftersom osäkra injektioner är vanliga. Betydande risk föreligger bland injektionsmissbrukare som även kan sprida HBV sexuellt.
I Sverige ses årligen ca 200-250 fall av akut hepatit B, varav ca hälften har förvärvats sexuellt och hälften genom injektionsmissbruk. Nästan alla nya kroniska infektioner utgörs av personer som flyttat till Sverige från länder med hög prevalens. Spridning från dessa kroniskt infekterade är ovanlig trots att Sverige tillhör en liten grupp länder som hittills avvaktat med att införa generell småbarnsvaccination mot hepatit B.
Smittsamheten vid HBV-infektion varierar kraftigt vilket avspeglar att HBV-DNA-nivåerna som ses hos olika patienter kan variera med en faktor av 1 miljon eftersom de nivåer man ser hos patienter varierar från 100 viruskopior/mL till över 1 miljard viruskopior/mL, eller från 2 till 9 log IU/mL (1 IU ≈ 5.82 kopior). Om smittrisken är proportionell mot nivån skulle alltså risken att smittas av en högsmittsam individ vara 1 miljon gånger mer högre än att smittas av en lågsmittsam individ om expositionen i övrigt är av samma slag. Risken för smittöverföring är också beroende av typen av exposition. Vid blodtransfusion är risken stor även om HBV-DNA-nivån är låg, men vid sexuell exposition, accidentella nålstick (nosokomialt) och partus (mor-barn) föreligger mycket högre risk om HBV-DNA-nivån hos smittkällan (partnern, patienten, mamman) är hög. Detta är bakgrunden till den gamla kunskapen att risken är större om smittkällan är HBeAg-positiv. I praktiken är det svårt att omsätta denna kunskap i skillnader i regler och handläggning, och därför är alltjämt smittskyddsreglerna oberoende av skillnader i smittrisk. Det görs dock viss skillnad i prevention av mor-barn-smitta (se nedan).
Prevention[redigera]
Vaccin i form av rekombinant HBsAg ges subkutant (alternativt intradermalt) i 3-4 doser. Generell barnvaccination finns i nästan alla världens länder. I Sverige rekommenderas vaccinet till riskgrupper såsom vis sjukvårdspersonal, dialys- och hemofilipatienter, injektionsmissbrukare, män som har sex med män (MSM), sexualpartners till känt HBV-smittade. Familje- och dagiskontakter kring smittsamma barn vaccineras.
Gravida kvinnor screenas avseende HBsAg för att förhindra vertikal smitta. Barn till HBsAg-positiva mödrar vaccineras direkt efter födseln och får sedan ytterligare 3-4 doser under första levnadsåret. Om mamman är HBeAg-positiv ges även hyperimmunglobulin (HBIG, dvs högkoncentrerat anti-HBs) för att blockera eventuellt överfört virus. Trots dessa åtgärder löper barn till högsmittsamma mammor (HBV-DNA över 8 log IU/mL) påtaglig risk att smittas och bli kroniska bärare. För at minska denna risk rekommenderas antiviralbehandling under sista trimestern.
Provtagning[redigera]
Indikation[redigera]
Utredning av akut och kronisk hepatit. Screening av vissa patientgrupper. Analys av blodgivare och organdonatorer är obligatorisk.
Prov för serologisk och nukleinsyrabaserad diagnostik[redigera]
- Serum (skickas vanligen som blod utan tillsats) rekommenderas för serologiska analyser.
- Vid HBV-DNA-analys kan serum eller plasma användas men uppmätt nivå kan skiljas sig beroende på om serum eller plasma som används. Serum rekommenderas därför eftersom det ofta är en fördel att kunna göra kompletterande HBV-DNA-analys av prov som primärt skickats för serologisk undersökning.
Eftersom flera serologiska analyser ofta behöver göras behövs minst 2 mL blod för serologisk diagnostik (helst 4 mL för att medge omsättning vid behov). Enbart HBV-DNA-analysen kräver 2 mL blod (helst 4 mL). För att vid behov möjliggöra alla analyser och omsättningar är det lämpligt att 8 mL blod skickas.
Laboratoriediagnostik[redigera]
Laboratoriediagnostiska kriterier[redigera]
- Akut HBV-infektion: Grunden för diagnosen är påvisande av anti-HBc IgM, och denna analys bör alltid utföras. I princip kan diagnosen också ställas om HBsAg eller HBV-DNA påvisas hos en individ som tidigare varit negativ avseende dessa analyser.
- Kronisk HBV-infektion: Diagnosen baseras på påvisande av HBsAg och anti-HBc IgG och avsaknad av (eller låg nivå av) anti-HBc IgM i serum. Om möjligt bör HBV-DNA-kvantifiering direkt utföras i alla fall av nyupptäckt kronisk infektion.
Serologi[redigera]
Serologisk diagnostik av HBV-infektion baseras på en kombination av flera analyser som kan påvisa virusproteiner (HBsAg och HBeAg) och antikroppar mot virusproteiner (anti-HBc, anti-HBe, anti-HBs). Analyserna görs i Sverige nästan uteslutande i analysrobotar, såsom Abbott Architect där påvisningen sker med kemiluminescens.
- HBsAg är det basala testet eftersom detta antigen är påvisbart i blodet hos alla med aktiv infektion, alltså vid såväl akut som kronisk infektion. HBsAg bildas i stort överskott och bildar subvirala partiklar som finns i mycket hög koncentration i blodet (≈ 10 – 10/mL). Syntesen är inte direkt kopplad till virusproduktionen, och HBsAg kan därför ofta påvisas även hos patienter som vid kronisk infektion inte längre har påvisbart HBV-DNA i blodet. De senaste åren har intresset för att kvantifiera HBsAg ökat eftersom nivån kan vara kliniskt betydelsefull för att bedöma behandlingseffekt och prognos. HBsAg-nivån ligger kring 5 log IU/mL hos patienter med högaktiv infektion, och sjukner till under 3 log IU/mL vid lågaktiv infektion. Hos ett fåtal (cirka 1 % per år av alla med kronisk infektion) sjunker HBsAg under detektionsgränsen och då blir i regel anti-HBs påvisbart.
- HBeAg bildas i mindre mängd än HBsAg och produktionen är i viss mån knuten till replikationen. Påvisande av HBeAg har klinisk betydelse som surrogatmarkör för virusnivå och är alltjämt en viktig markör för kliniskt stadium. Dess funktion är alltjämt oklar, men man anser att HBeAg är viktig för att modulera (dämpa) immunsvaret. När väl immunsvaret aktiverats tycks fortsatt HBeAg-produktion vara till nackdel för virus eftersom virus med mutationer som stänger av eller minskar syntesen av HBeAg då selekteras fram. När HBeAg inte längre kan påvisas vid kronisk infektion har i regel ett effektivt immunsvar aktiverats och HBV-DNA sjunkit under 6 log IU/mL. HBeAg ersätts så småningom i blodet av motsvarande antikropp, anti-HBe. Ibland kvarstår eller återkommer hög HBV-DNA-nivå trots negativ HBeAg, och i dessa fall har nästan alltid stammar med mutationer (i precoreregionen eller i corepromotorregionen) som blockerar HBeAg-syntes selekterats.
Vid akut infektion kan HBeAg påvisas kort efter HBsAg och är uttryck för höga virusnivåer. Om HBeAg kvarstår längre än 8 veckor finns påtaglig risk för utveckling av kronisk hepatit.
- IgG-antikroppar mot viruskapsiden (anti-HBc) ses vid såväl pågående som genomgången infektion. De uppträder tidigt och kan ibland påvisas redan vid det kliniska insjuknandet. Påvisande av anti-HBc av IgM-typ är av stor betydelse för diagnostiken akut hepatit B och ska alltid göras vid sådan misstanke, alltså även om HBsAg är negativt, och bör göras i alla fall av tidigare inte känd HBsAg positivitet.
Antikroppar mot HBsAg (anti-HBs) blir påvisbara efter det att HBsAg försvunnit. Vid akut infektion kan detta dröja flera veckor, vid kronisk hepatit flera månader. Individer med immunitet efter genomgången infektion är vanligen positiva för både anti-HBs och anti-HBc under många år. Efter 10-20 år kan anti-HBs försvinna, medan anti-HBc ofta kvarstår livslångt.
Immunitet kan även uppnås med vaccination (rekombinant HBsAg givet i 3-4 doser), och nivåer av anti-HBs över 10 IU/mL är skyddande. Individer med vaccininducerad immunitet saknar anti-HBc.
Nukleinsyrabaserade metoder[redigera]
HBV-DNA-kvantifiering[redigera]
Denna analys är av stor betydelse för bedömning av prognos, smittsamhet och behandlingssvar. Med realtids-PCR kan nivåer från 2 till 9 log IU/mL bestämmas med god mätsäkerhet. Vid kronisk infektion bör analysen upprepas flera gånger första året, därefter 1-2 gånger per år eller glesare beroende på kliniskt stadium.
Det finns påtaglig risk för allvarlig leverskada on HBV-DNA-nivån är över 5-6 log IU/mL, medan risken är liten om nivån är under 4 log IU/mL. Vid nivåer mellan 4-5 log/mL risken i regel låg för fortsatt inflammationsskada, men cancerrisken kan vara signifikant hos en del, särskilt om cirros redan utvecklats, vilket kräver vaksamhet.
HBV-DNA-mätningar är avgörande för att bedöma effekten av behandling. Nyttan att kvantifiera HBV-DNA vid akut infektion är mer osäker.
Genotypning[redigera]
Baserat på genetiska skillnader indelas HBV i genotyper. Det finns 8 etablerade (A-H) och två föreslagna (I-J) genotyper.
Genotypning har klinisk betydelse eftersom det finns skillnad i leverskaderisk och effekt av behandling, särskilt genom att genotyp C ger mer leverskada och genotyp A tycks svara bra på interferonbehandling. Det finns också ett antal beskrivna subgenotyper, men det är tveksamt om de har någon klinisk betydelse.
Tidigare användes ett typningssystem baserat på serologisk metodik. Indelningen (adw, adr, ayw, ayr) har visats korrelera till variation av ett fåtal aminosyror i HBsAg, och har viss samvariation med genotyperna.
Genotypning har också viss betydelse för smittspårning för att klargöra spridning av HBV. Om olika genotyper påvisas är smittsamband osannolikt. Om samma genotyp påvisas kan ytterligare analys av genomet ofta vara klargörande. Sådan analys görs med sekvensering av delar av genomet.
Svarsrutiner[redigera]
Resultat av serologisk analys (HBsAg, HBeAg, anti-HBc, anti-HBe, anti-HBs) anges som positivt eller negativt (alternativt påvisat eller ej påvisat). Vid nyupptäckta eller svårbedömda fall bör laboratoriet utan anmodan av beställaren komplettera så att en helhetsbedömning kan göras (akut infektion, kronisk infektion, ospecifik reaktion).
HBV-DNA besvaras kvantitativt, i regel som IU/mL.
Genotyp besvaras som genotyp A-H, eventuellt med tilläg av subgenotyp.
Laboratorierapportering[redigera]
Hepatit B-infektion är anmälningspliktig enligt smittskyddslagen. Vid rapport av nytt fall bör förutom HBsAg även uppgift om anti-HBc IgM, HBeAg och HBV-DNA anges.
Anmäls enligt gällande falldefinition
Referensfunktioner[redigera]
Enligt virologisk R-lista
REFERENSER[redigera]
- 1. Kao JH. Diagnosis of hepatitis B virus infection through serological and virological markers. Expert Rev Gastroenterol Hepatol. 2:553-62; 2008
- 2. Alazawi W, Foster GR. Advances in the diagnosis and treatment of hepatitis B. Curr Opin Infect Dis. ;21:508-15; 2008
- 3. Norder H, Couroucé AM, Coursaget P, Echevarria JM, Lee SD, Mushahwar IK, Robertson BH, Locarnini S, Magnius LO. Genetic diversity of hepatitis B virus strains derived worldwide: genotypes, subgenotypes, and HBsAg subtypes. Intervirology. 47:289-309, 2004.
- 4. Hollinger FB. Hepatitis B virus genetic diversity and its impact on diagnostic assays. J Viral Hepat. Suppl 1:11-5. 2007