Provsättning
Till innehållsförteckngen för Referensmetodik: Bakteriologisk diagnostik av infektioner i hud, mjukdelar, skelett och inre organ
Ankomstkontroll på laboratoriet[redigera]
- Kontrollera;
- att provkärlens/objektglasens märkning och antal överensstämmer med remiss.
- att beställare finns angivet.
- att rekommenderat provmaterial tagits till undersökningen.
- att rekommenderad transporttid ej överskridits.
Avvikelser från ovanstående bör föranleda diskussion med beställaren. Om behandlande läkare anser nytt prov inte kan tas och att analysen ska utföras och rapporteras trots felaktigheter på det inkommande provet, ska felkällorna kommenteras i laboratorierapporten.
Provsättning[redigera]
Allmän odling, referensmetodik[redigera]
1. Aerob odling
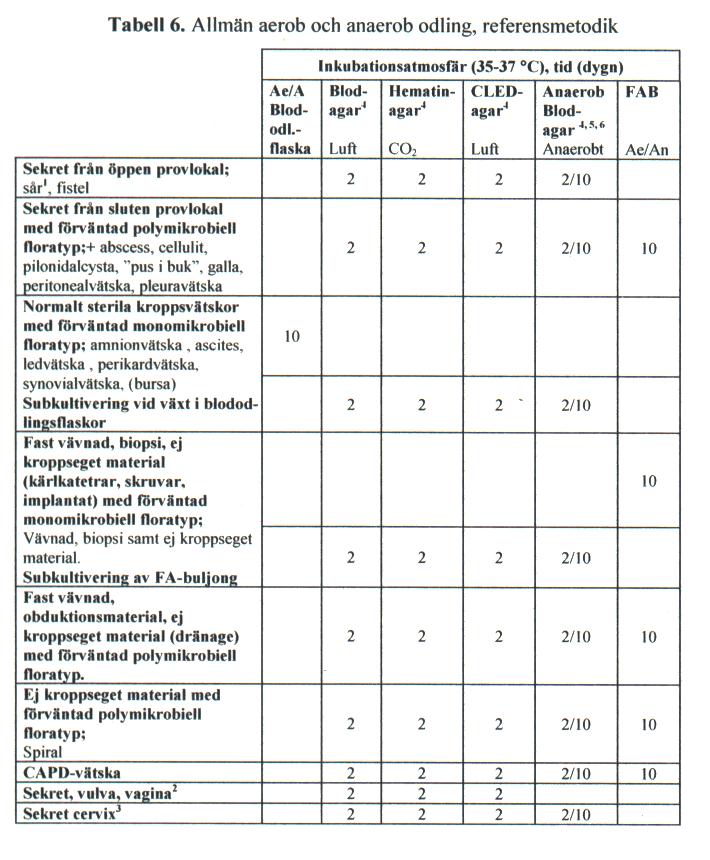
Alla typer av prov, definierade i tabell 6, odlas primärt på blodagar, hematinagar och CLED-agar. I förekommande fall sätts prov också till anrikningsbuljong, FAB. Prov som anländer till laboratoriet i blododlingsflaskor, inkuberas upp till 10 dygn och sekundärsprids närhelst indikation till växt föreligger. Sådana prov som utgörs av fast vävnad etc., vilka överförs till anrikningsbuljong, sekundärsprids på agarplattor av samma sort. Buljongen inkuberas totalt 10 dygn.
2. Anaerob odling, rutinnivå
Metoden avser miniminivå för anaerob odling som i förekommande fall kompletterar aerob odling, se också tabell 6, fotnot 4. Prov inokuleras på anaeroba blodplattor, FAA (se nedan), som görs semiselektiva genom applikation av aminoglykosid- och metronidazollappar i primärstryket (se tabell 6, fotnot 5). Inokulera även anaerob buljong (FAB) som inkuberas aerobt eller anaerobt.
De anaeroba blodplattorna bör vara prereducerade eller färska. Inokulering sker i anaerobbox (referensmetod), men aerob provsättning med sekundär inkubering i klocka med gasgenererande kuvert som t.ex. Anaerogen (OXOID) eller i klocka med evakueringssystem är accepterad alternativ metodik. Med kuvert erhålls god anaerobios tillräcklig för flertalet kliniskt relevanta anaeroba bakterier. Med resazurin som indikator garanteras redoxförhållanden ≤ 110 mV. Avläs dag 2 eller efter medicinsk bedömning. Observera att anaerobt inkuberade plattor inte bör exponeras för luft under de första 48 timmarna. Vissa långsamväxande arter, hit hör peptostreptokocker och svartpigmenterade gramnegativa stavar som Porphyromonas, Prevotella, och Bilophila kan behöva inkuberas ytterligare en eller flera dagar för detekterbara kolonier. Andra anaeroba bakterier, t.ex. Actinomyces kan behöva 7-10 dagars inkubationstid. FAB granskas för växt dagligen upp till 10 dygn.
Den förenklade anaeroba odlingen är med beskrivna förbehåll fullt acceptabel i rutindiagnostiken. Det enskilda laboratoriet definierar utifrån denna miniminivå eventuell modifiering av anaerobdiagnostiken, innefattande förlängd inkuberings¬tid, bruk av selektiva medier (se nedan), särskilt i de fall anaerob odling speciellt begärts.
3. Anaerob odling, jämförelsenivå
Metoden bör användas vid studier men kan även användas i rutinen efter särskild medicinsk bedömning. Prov inokuleras på prereducerade eller färska anaeroba blodagarplattor, d.v.s. FAA, samt två typer av selektiva FAA; kana-vanko-agar och neomycinagar (enligt bilaga 1). Inokulera även anaerob buljong (FAB) i förekommande fall och inkubera denna anaerobt. För anaerob miljö används anaerobbox i vilken all hantering av provet sker (miljö 10 % H2, 5-10% CO2, 80-85 % N2. Alternativ är inkubering i någon typ av klocka (se under punkt 2).
Inkubera anaeroba plattor och eventuell buljong 10 dygn. Daglig avläsning.
Speciell odling, referensmetodik[redigera]
Tabell 6[redigera]
Tabell 7.[redigera]
Val av medier, atmosfär, temperatur och inkubationstid beskrivs i tabell 7.
Inokulering av medier[redigera]
Allmänt[redigera]
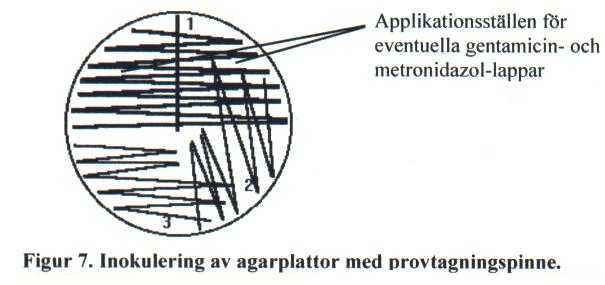
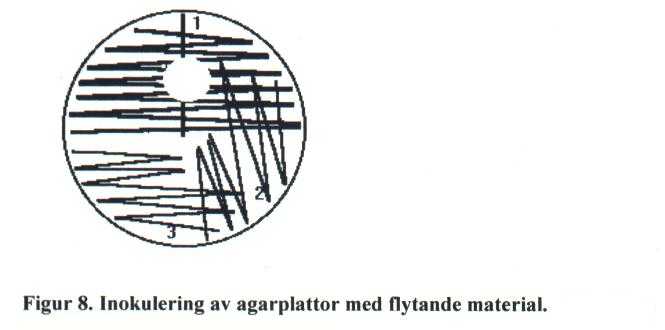
Inokulera alltid medier i en bestämd ordning med det minst selektiva mediet först. Provmaterialet kan kastas en vecka efter att provet primärodlats, eller efter medicinsk bedömning. Lämpliga metoder för provapplikation på agarplattor beskrivs i figur 7 och 8. Märk först agarplattorna med Labnr och inokuleringsdatum. Primärstryk i förekommande fall med provtagningspinne (fig 7) eller applicera ca 100 mikroL material på plattan (fig 8).
Gör först ett rakt primärstryk. Stryk sedan vinkelrätt mot detta första stryk. Rotera pinnen under hela stryket. Återställ provtagningspinnen i transportröret. Sekundärstryk med plastinös enligt 2 och 3.
Primärstryk agarplattorna med plastinös enligt 1. Stryk först ett rakt stryk. Stryk sedan vinkelrätt mot detta första stryk. Sekundärstryk med plastinös enligt 2 och 3.
Inokulering av flytande medier[redigera]
Märk buljongrör med Labnr och inokuleringsdatum.
Ta provmaterial med engångs plastpipett/sterila instrument och inokulera mediet.
Direktmikroskopi[redigera]
Märk objektglas med Labnr.
Ta provmaterial med engångs plastpipett/sterila instrument och stryk på objektglaset.
Provmaterialrelaterad beskrivning[redigera]
Allmän odling[redigera]
Sekret pinnprov i transportrör
- Öppna transportröret och ta ut provtagningspinnen.
- Inokulera och inkubera medier.
Sekret i anaerob transportflaska eller sterilt rör/kärl
- Homogenisera innehållet genom att vortexa eller vända det förslutna röret några gånger.
- Öppna röret och ta material med engångs plastpipett. Förslut röret.
- Inokulera och inkubera medier. Gör anaerob odling först.
Vävnad i sterilt rör/kärl
- Öppna röret och ta material.
- Placera materialet i steril mortel.
- Homogenisera materialet i steril mortel. Tillsätt lite FA-buljong om provet är torrt.
- Inokulera och inkubera medier. Gör anaerob odling först.
Vävnad i FA-buljong med tecken på växt vid ankomst
- Vortexa eller vänd det förslutna röret några gånger.
- Öppna röret och ta material med engångs plastpipett. Förslut röret.
- Inokulera och inkubera medier. Gör anaerob odling först.
Vävnad i FA-buljong utan tecken på växt vid ankomst
- Inkubera röret.
- Inokulera och inkubera medier vid tecken på växt. Vid tveksamhet om växt är det lämpligt att gramfärga buljongen samt subkultivera till agarplattor.
Ej kroppseget material i FA-buljong
- Inkubera i 10 dygn i 35 °C - 37 °C.
- Inokulera och inkubera medier vid tecken på växt. Vid tveksamhet om växt är det lämpligt att gramfärga buljongen samt subkultivera till agarplattor.
Ej kroppseget material i sterilt rör/kärl med förväntad monomikrobiell floratyp
- Öppna röret och placera materialet i FA-buljong.
- Inkubera i 10 dygn i 35 °C - 37 °C.
- Vid växt ta material från buljongröret. Inokulera och inkubera medier.
Ej kroppseget material i sterilt rör/kärl med förväntad polymikrobiell flora¬typ (spiral, dränage)
- Placera under anaeroba och sterila betingelser.
- spiralen i steril petriskål och tillsätt FA-buljong. Skaka försiktigt.
- alternativt i FA-buljongrör och vortexa.
- Inokulera medier med hjälp av plastpasteurpipett. Gör anaerob odling först.
Blododlingsflaskor med tecken på växt vid ankomst
- Odla ut vid ankomsten.
- Inokulera och inkubera medier.
- Tillsätt näringssubstrat enligt tillverkarens anvisningar.
- Inkubera flaskorna ett dygn i 36 °C innan eventuell ny utodling (eller tills blod¬odlingssystemet signalerar).
- Om det växer rikligt på direktutodlade medier behöver provet inte odlas ut igen.
Blododlingsflaskor utan tecken på växt vid ankomst
- Tillsätt näringssubstrat enligt tillverkarens anvisningar.
Inkubera flaskorna i 36 °C och avläs i fem dygn (eller tills blododlingssystemet signalerar) innan eventuell utodling. Inokulera och inkubera medier.
CAPD (PD), dialysvätska
- Desinficera dialyspåsen.
- Aspirera 100 mL dialysvätska och sätt till 2st 50 mL centrifugrör.
- Centrifugera båda rören i 2000 x g, 10 min.
- Sug av ovanvätskan med steril engångspipett av plast. Kasta ovanvätskan. Om endast liten mängd sediment, lämna kvar totalt ca 2 mL i röret för utodling.
- Inokulera från sedimentet: 0,1 mL/agarplatta samt 0,5 mL till anrikningsbuljong.
- Lägg ev. material på ett märkt objektsglas för direktmikroskopi.
- Om blododlingsflaskor eventuellt använts, åtgärdas de enligt ovan.
Speciell odling[redigera]
GBS-odling
- Inokulera provtagningspinnarna från vagina respektive rektum tillsammans i anrikningsbuljong för grupp B streptokocker, ”GBS-buljong”.
- Inkubera buljongen i 1 dygn 35 o-37 °C.
- Inokulera en fårblodagarplatta med den inkuberade buljongen.
- Inkubera plattan i 35 °C -37 °C . Avläs efter 1 dygn. Om ingen växt av GBS, reinkubera agarplattan 1 dygn .