Skillnad mellan versioner av "Speciell epidemiologi-Nedre luftvägsinfektioner"
| (En mellanliggande sidversion av samma användare visas inte) | |||
| Rad 103: | Rad 103: | ||
=== Invasiv infektion med GAS === | === Invasiv infektion med GAS === | ||
| − | I ett material omfattande 144 patienter med invasiv [[GAS]]-infektion under perioden 1/1-96 till 31/5-97 angavs pneumoni som fokus i 9 fall (Björn Eriksson et al. Clin. Inf. Dis. 2003;37:1189-1193). | + | I ett material omfattande 144 patienter med invasiv [[Streptococcus pyogenes|GAS]]-infektion under perioden 1/1-96 till 31/5-97 angavs pneumoni som fokus i 9 fall (Björn Eriksson et al. Clin. Inf. Dis. 2003;37:1189-1193). |
| − | |||
=== Invasiv pneumokockinfektion === | === Invasiv pneumokockinfektion === | ||
| Rad 154: | Rad 153: | ||
| − | === Papegojsjuka (ornithos) – ''Chlamydophila psittaci'' === | + | === Papegojsjuka (ornithos) – ''Chlamydophila psittaci'' (uppdaterad maj 2012) === |
| − | Infektioner av '' | + | Infektioner av ''C. psittaci'' uppträder som enstaka fall eller som mindre utbrott med gemensam smittkälla. Smittkälla kan vara t.ex. duvslag eller fågelfarmer liksom affärer för sällskapsdjur. Sekundärfall uppträder som regel inte. Papegojsjuka förekommer över hela världen. I Sverige rapporterades under 1980-talet omkring 100 fall årligen. Under det senaste årtiondet har mellan två och 24 fall anmälts per år. Det finns ingen uppenbar förklaring till denna minskning, men en möjlig orsak är att färre personer provtas för infektionen numera. |
| − | |||
Vaccin saknas. | Vaccin saknas. | ||
| − | |||
=== Q feber -'' Coxiella burnetii'' === | === Q feber -'' Coxiella burnetii'' === | ||
Nuvarande version från 23 april 2013 kl. 12.03
Till innehållsförteckningen för Referensmetodik: Nedre luftvägsinfektioner, 2:a upplagan 2005
Se även Smittskyddslagen, tillämpningar
Allmänfarliga sjukdomar[redigera]
Meticillinresistenta Staphylococcus aureus – MRSA[redigera]
MRSA blev anmälningspliktig från och med år 2000. Dessförinnan övervakades läget genom den frivilliga laboratorierapporten. Man kunde där få en viss uppfattning om förekomsten, men det var svårt att värdera kvaliteten och täckningsgraden på siffrorna.
Under den tid MRSA varit en anmälningspliktig diagnos har antalet fall ökat från 322, år 2000, 424, år 2001 till 441, år 2002 och 547 år 2003. Anmälningar har inkommit från samtliga 21 landsting. Storstadslänen, Skåne, Stockholm och Västra Götaland, står för 395 (72 %) av det totala antalet fall. Man kan se en stigande trend i antalet fall för Stockholms län med 97, 166, 205 och 228 fall för respektive år. Även för Skåne ses en stigande trend med 22, 74, 68 och 104 fall för motsvarande år. År 2003 rapporterade 14 av landets 21 län, fler fall än året före. Fallen i Stockholms län utgjorde 42 % av landets samtliga anmälda fall, samtidigt som befolkningen där utgör cirka 20 % av hela riket.
Av rapporterade fall 2003 var 55 % infekterade med MRSA, och resten enbart koloniserade.
Bland de anmälningar där smittlandet var känt, angavs Sverige som smittland i 76 % av fallen. Mer än hälften av de importerade fallen hade smittats med MRSA i sjukvårdsinrättningar. Även bland de inhemskt smittade var sjukvårdsinrättningar en vanlig källa till smitta (53 %).
Molekylärepidemiologisk typning med PFGE visade att mer än 80 % kunde relateras till internationellt kända kloner. Det vanligaste typningsmönstret (23 %) var identiskt med eller relaterat till UK E15, en epidemisk klon som dominerat i Storbritannien sedan slutet av 1990-talet. Denna typ förekom huvudsakligen i Stockholms län, medan de två näst vanligaste, DK E97-1 och Berlin IV liknande, förekom i mer än hälften av landstingen.
Penicillin-resistenta pneumokocker - PRP[redigera]
Infektion av pneumokocker med MIC mot PcG ≥ 0,5 mg/L. Antalet anmälda fall av PRP har legat relativt stabilt, år 2003 med drygt 500 anmälda fall. Som tidigare är majoriteten av de anmälda fallen barn under 6 år. Endast enstaka fall rapporteras med ett MIC PcG över 2 mg/L, och majoriteten av dessa fall har smittats utomlands.
Under de åtta åren 1996-2003 som PRP har varit anmälningspliktig har den nationella incidensen minskat kontinuerligt. Denna minskning har närmast uteslutande skett bland de yngsta åldrarna (0-6 år), medan incidensen i övriga åldersgrupper har legat mer stabil.
Det finns dock indikationer på att diagnosintensiteten har minskat under perioden, och detta skulle också kunna vara en förklaring till den minskande incidensen. En minskande trend ses i incidensen av det totala antalet isolerade pneumokocker (oavsett resistens), samt en minskning i antalet utförda nasofarynxodlingar i landet.
Rutiner och indikationer för smittspårning kring kliniska fall av PRP varierar betydligt mellan de olika landstingen, vilket gör det svårt att jämföra siffror mellan länen. I vissa områden genomförs en aktiv och intensiv smittspårning vilket resulterar i att fler asymtomatiska fall identifieras, jämfört med län där endast personer som aktivt söker vård provtas.
Mjältbrand - Bacillus anthracis[redigera]
Hos människa blev den pulmonära formen av antrax tidigt känd som Woolsorter´s disease.
Vid ett mycket omskrivet utbrott som började i Florida oktober 2001 och som orsakades av infekterade brev inträffade 22 fall av vilka 11 var pulmonella och av dessa 5 med dödlig utgång.
Under den senaste 10-årsperioden har inget fall av mjältbrand anmälts i Sverige.
Pest - Yersinia pestis[redigera]
Under den senaste 10-årsperioden har inget fall av pest anmälts i Sverige.
Svår akut respiratorisk sjukdom - SARS[redigera]
Under våren 2003 genomlevde världen en epidemi av ett nytt och till en början okänt luftvägsvirus, SARS. Totalt rapporterades 8096 fall varav 774 avlidna. De områden som drabbades hårdast var Kina, Hongkong, Toronto i Kanada, Taiwan, Singapore och Vietnam.
SARS blev i maj 2004 klassad som allmänfarlig sjukdom i smittskyddslagen. SARS-liknande virus finns fortfarande bland smådjur i södra Kina, och virus överfördes troligen ett par gånger från djur till människa 2003. Närkontakt med smittade djur är den viktigaste förutsättningen för att en ny epidemi ska uppkomma. De SARS-virus som spreds mellan människor 2003 hade troligen låg smittsamhet, och stor smittdos var en förutsättning för att sjukdomen skulle spridas. Virus verkar huvudsakligen spridas med droppsmitta, men fall av luftsmitta kan ha förekommit. Inkubationstiden är vanligen 2–5 (upp till 10 dagar). Smittsamheten är i normalfallet mycket låg eller ingen under inkubationsfas och tidig sjukdom. De svårast sjuka patienterna som kom till sjukhus utsöndrade mycket virus, och speciellt vårdpersonal och medpatienter blev smittade. Subklinisk infektion verkar vara mycket ovanlig. Vissa infekterade blev under epidemin ”superspridare”. Om detta berodde på att de utsöndrade mycket virus eller ett mer humananpassat virus än andra är inte klarlagt, men man har kunnat följa långa smittkedjor från sådana personer. Efter juli 2003 har fyra små SARS-utbrott konstaterats. Tre av dess har varit laboratoriesmitta. SARS-CoV växer snabbt till mycket höga titrar i apnjureceller, och odling av virus ställer mycket stora krav på biosäkerhet.
Tuberkulos - Mycobacterium tuberculosis[redigera]
Var tredje människa i världen är smittad med tuberkelbakterier och har en latent infektion. Omkring 10 milj. insjuknar årligen i tbc och 2-3 milj. dör av sjukdomen.
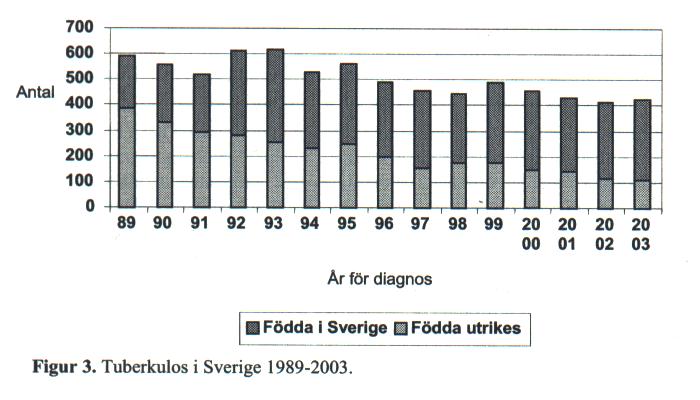
Sverige tillhör de länder i världen som har lägst förekomst av tuberkulos. Under 2000-talet har antalet nya tbc-fall legat på ungefär samma nivå, omkring 420 per år motsvarande 5 fall per 100 000 invånare och år. I den svenskfödda befolkningen rapporteras 110-120 nya fall per år motsvarande knappt 2 per 100 000 invånare. I den utrikes födda befolkningen har antalet nya fall legat stationärt med omkring 300 per år, vilket motsvarar ca 30 per 100 000 och år (Figur 3).
Andelen utrikes födda med tbc har ökat stadigt och överstiger nu 70 % av all nyupptäckt tbc i Sverige. Över hälften av de utrikes födda tbc-patienterna kommer från Afrika eller Asien. Bland invandrare från vissa länder har incidensen varit 10-20 gånger högre. Somalia har under senare år blivit det vanligaste ursprungslandet bland utrikes födda tbc-patienter i Sverige. Incidensen per 100 000 invånare från Somalia beräknades år 2001 till 512.
Antalet patienter med tuberkulos orsakad av en resistent M. tuberculosis har under perioden 1991-2003 uppgått till ca 40 per år (9,5 %), med variation mellan 23 och 59 per år. Multiresistens d.v.s. resistens mot isoniazid och rifampicin har rapporterats hos i genomsnitt fyra patienter per år (ca 1 %).
Under perioden 1996-2002 inträffade 70 fall med INH-resistent M. tuberculosis med identiskt genetiskt mönster vid molekylärbiologisk typning. Majoriteten var födda på Afrikas horn men hade insjuknat efter flera års vistelse i Sverige. Smittspridningen hade antagligen ägt rum i Sverige och de flesta patienterna i detta kluster tillhörde en gemensam smittkedja.
Övriga anmälningspliktiga sjukdomar[redigera]
Harpest (tularemi) – Francisella tularensis[redigera]
Harpest är en zoonos som sprids från smågnagare och hare till människa via direktkontakt, insektsbett eller via inandning av aerosoler och damm, förorenat av sjuka djurs avföring eller urin. En viktig riskfaktor vid pneumoniformen är aerosolbildning som kan uppstå vid motoriserat trädgårdsarbete under fuktig väderlek. Bakterien kan, ehuru ej sporbildande, överleva månadsvis i vattenrik miljö.
Harpest förekommer i de flesta länder på norra halvklotet men inte söder om ekvatorn. Utbrott av tularemi har de senaste åren även beskrivits i Spanien och i Kososvo. Tularemi får därför anses vara en "emerging infection".
Tularemi är endemiskt förekommande i Sverige. Traditionellt har ett område i Dalarna, Hälsingland och Gästrikland varit en "hotspot", men under senare år har det endemiska området utvidgats söderut. Svensk skogshare är känsligare än fältharen med hög dödlighet och det är möjligt att subkliniska former hos den senare bidrar med fler fall hos jägare. I Sverige anses mygg vara den viktigaste vektorn för smittspridning.
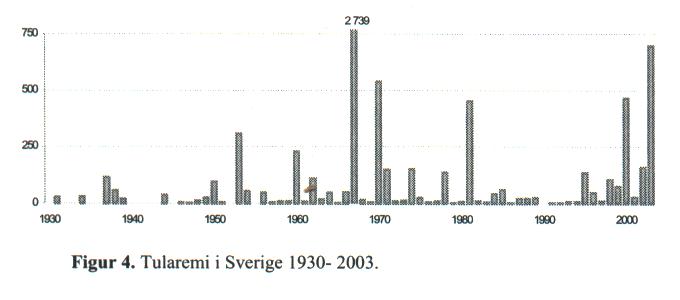
Antalet anmälda tularemifall varierar mycket år från år. År 2003 var ett rekordår med 698 rapporterade fall vilket är det högsta antalet sedan 1966, då det var ett utbrott med 2739 anmälda tularemifall. Andra stora "tularemiår" var 1970, 1981 (452 fall) och 2000 (464 fall), se Figur 4 nedan.
Vad som orsakar den stora spridningen av harpest i Sverige de senaste åren (2000 och 2003) är oklart. Det ses både en ökning av antalet fall men också en spridning i områden där vi inte tidigare haft rapporterade fall. Det har spekulerats i om ökningen bland annat beror på våta somrar och mycket mygg.
Flest fall 2003 rapporterades smittade i Dalarna, Närke och Gästrikland. Från Hälsingland där det så gott som varje år förekommer fall har det endast rapporterats en handfull fall under året. Anmärkningsvärt är också att 27 personer uppgett att de smittats i Bohuslän som endast haft enstaka fall de senaste 20 åren.
Av de 698 tularemifallen anmälda under 2003 var 56 % män och medelåldern var 47 år.
Infektion med icke-tuberkulösa mykobakterier – Mycobacterium species (atypiska)[redigera]
Icke-tuberkulösa mykobakterier är opportunister som i första hand framkallar sjukdom hos personer med nedsatt immunförsvar eller underliggande kronisk sjukdom. Antalet rapporterade fall av icke-tuberkulösa mykobakterier uppgick åren 2000 till 2003 till mellan 246 och 286 fall per år.
Icke-tuberkulösa mykobakterier rapporteras internationellt i ökande omfattning vara associerade till nosokomiala utbrott. Smittspridning har bl.a. kunnat hänföras till vattenledningsvatten och kontaminerat vatten i badpooler. Det är oklart i hur många fall som odlingsfynd från luftvägarna (69 %) haft klinisk relevans. Extrapulmonella fynd (lymfkörtlar, pleura, urin, blod, feces) bedöms dock alltid vara av klinisk betydelse.
Artbestämning visade som tidigare år en dominans av Mycobacterium avium-intracellulare (50 %) följt av M. malmoense, M. marinum, M. fortuitum och M. gordonae.
Invasiv infektion med Haemophilus influenzae[redigera]
Efter 1992 då vaccination mot Hib infördes i det svenska vaccinationsprogrammet har vi i likhet med alla andra länder, som infört denna vaccination, sett en dramatisk minskning av invasiv infektion med Haemophilus influenzae, typ b, bland barn under 5 år. Under 2003 anmäldes 23 personer med Hib, vilket gav en incidens på 0,3 fall per 100 000 invånare.
Invasiv infektion med GAS[redigera]
I ett material omfattande 144 patienter med invasiv GAS-infektion under perioden 1/1-96 till 31/5-97 angavs pneumoni som fokus i 9 fall (Björn Eriksson et al. Clin. Inf. Dis. 2003;37:1189-1193).
Invasiv pneumokockinfektion[redigera]
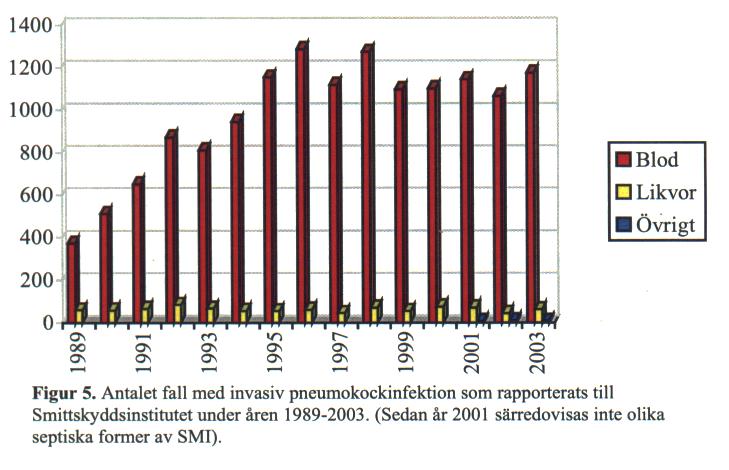
Antalet rapporterade fall med invasiv sjukdom orsakad av pneumokocker ökade dramatiskt under 1990-talet. Med molekylära metoder har visats att spridningen av två specifika kloner (nära släkt) av typ 1 och 14 stod för en stor del av ökningen. De senaste åren har antalet invasiva fall legat på drygt 1100 fall per år (se figur 5).
Pneumokocker är en av de vanligaste orsakerna till morbiditet och mortalitet associerat med bakteriella luftvägsinfektioner. De är den vanligaste orsaken till otit, samhällsförvärvad pneumoni, och sedan introduktionen av Hib-vaccination, även till bakteriell meningit. I 20-30 % av fallen med pneumoni har patienterna även en sepsis. Trots tillgång till antibiotika och intensivvård är dödligheten i dessa vanliga infektioner alltjämt hög. I USA beräknar man att ca 5 % dör av en pneumoni, 20 % av en sepsis och 30 % av en meningit orsakad av pneumokocker. I världen beräknas ca 20 miljoner barn varje år insjukna i en pneumoni orsakad av pneumokocker och ca 1 miljon av dessa barn dör av infektionen. Riskgrupper för att insjukna i en pneumokockinfektion är de små barnen och de äldre vuxna, samt patienter med kroniska sjukdomar och immunnedsatta individer t.ex. HIV-infekterade patienter, patienter med sickle-cell anemi och splenektomerade.
Ett polysackaridbaserat vaccin har funnits tillgängligt sedan många år. I detta ingår de 23 vanligaste serotyperna enligt studier i USA (23-valent). Tyvärr har protektionen framför allt i riskgrupperna (se ovan) inte varit tillräckligt god varför nya så kallade konjugatvaccin utvecklats varvid polysackariden kopplats till ett protein för att ge ett bättre immunsvar. Idag finns ett 7-valent vaccin på marknaden och fler är under utveckling. Även proteinbaserade vaccin håller på att tas fram.
Kikhosta – Bordetella pertussis[redigera]
Kikhosta sprids förmodligen enbart genom droppsmitta. Smittsamheten är mycket stor. Bakterierna sprids dessvärre redan under slutet av inkubationsfasen. Svenska incidensberäkningar bygger på rapportering. Underrapporteringen har dock varit betydande. En Göteborgsstudie av barn födda 1980 visade att 60 % hade haft klinisk kikhosta vid 10 års ålder och ytterligare 25 % asymtomatisk eller subklinisk infektion.
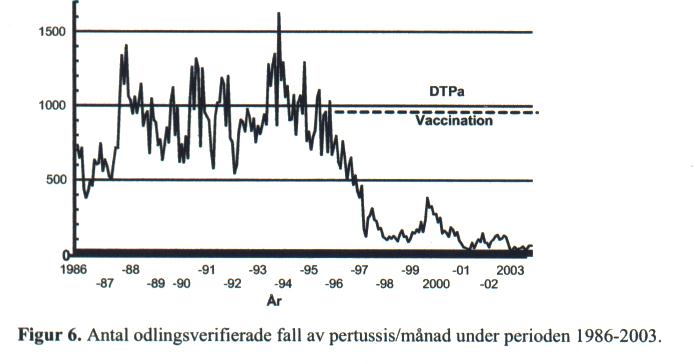
Efter återinförande av vaccination mot kikhosta i det allmänna vaccinationsprogrammet 1996 har sjukdomen minskat kraftigt. År 2003 rapporterades totalt 664 fall, vilket innebär en halvering jämfört året innan. Under de vaccinfria åren cirkulerade kikhosta med toppar vart 3-5 år, och i viss mån verkar det mönstret hålla i sig. Senaste toppen var 1999-2000. En ökning har också registrerats under 2004. Åren 1999-2003 har vi haft 25-26-11-13-7 odlingsverifierade fall per 100 000 invånare, vilket är lika lågt som på 60-talet när ett fungerande kikhostevaccin av helcellstyp användes. Så sent som 1994 inträffade i Sverige 150 fall per 100 000 invånare.
Kikhostan har minskat mest i vaccinerade åldersgrupper. För att bedöma de nya vaccinernas effektivitet på längre sikt pågår sedan hösten 1997 en fördjupad uppföljning av kikhosta bland de årskullar som är vaccinerade enligt det nya programmet, med telefonintervjuer kring alla fall av odlingsverifierad kikhosta i vaccinerade årskullar. Denna uppföljning visar att de allra flesta fallen bland barn under 1 år inträffar bland dem som är ovaccinerade eller som har fått endast en dos. Att lägga märke till är att 3-5 mån gamla barn, som fått sin första vaccination, har en betydligt lägre risk för att bli sjukhusinlagda p.g.a. kikhosta jämfört med barn under 3 månader. Enbart åldersskillnaden kan knappast förklara detta, d.v.s. även om första dosen inte skyddar mot insjuknande är det troligt att den ger ett visst skydd mot allvarlig sjukdom. Totalt rapporterades 2003 bland spädbarn 230 fall/100 000, vilket ska jämföras med cirka 600-800/100 000 under åren 1994-95. Under 10-årsperioden 1981-1990 rapporterades totalt 6 dödsfall. Oroande är nu att 6 dödsfall inträffat sedan 1996 i de mest utsatta åldrarna under 6 mån. Från 1950-talet fram till 1979 användes ett helcellsvaccin- Pw- mot kikhosta i det allmänna vaccinationsprogrammet. Sviktande effektivitet och oro för biverkningar gjorde att denna vaccination upphörde för att återupptas 1996, då med acellulära vacciner-DTPa. I Sverige används vacciner baserade på två komponenter (PT + FHA) eller på tre komponenter med tillägg av pertaktin.
Värdet av en påfyllnadsdos kikhostevaccin kring skolstarten diskuteras i Sverige och internationellt, liksom också andra strategier som mer specifikt skulle kunna minska riskerna för och med kikhosta under 6 månaders ålder. Det epidemiologiska intresset riktas nu alltmer mot smittspridning från äldre. Något kroniskt bärarskap har dock ej kunnat påvisas. I en svensk hushållsstudie visade 40 % av hushållsmedlemmar som exponerats för odlingsverifierad kikhosta serologiska tecken på infektion. Endast 22 % utvecklade dock symtom.
Legionella-infektion– Legionella species[redigera]
Legionella-bakterier kan finnas överallt där det finns sötvatten, men som regel då i låga antal. Vid särskilda betingelser kan bakterierna emellertid anrikas, t.ex. i av människan uppbyggda vattensystem. De tillväxer då i rörsystemens biofilm om temperaturförhållandena så medger. Infektioner orsakade av L. longbeachae har i Australien visats härröra från kontaminerad fuktad planteringsjord.
Både epidemiska och sporadiska utbrott förekommer. Stora utbrott i Sverige inträffade i Västerås 1979 (60 fall), Värnamo 1990-1991 (31 fall) och i Uppsala 1996-98 (18 fall).
Hösten 2002 inträffade ett utbrott i Sverige av Pontiac-feber; 23 personer insjuknade efter att ha badat i en bubbelpool i Skövde. Legionella pneumophila serogrupp 3 påvisades hos sjuka personer och i höga halter från vattnet i bubbelpoolen samt även från duschvatten.
En stor del av anmälda fall smittas utomlands.
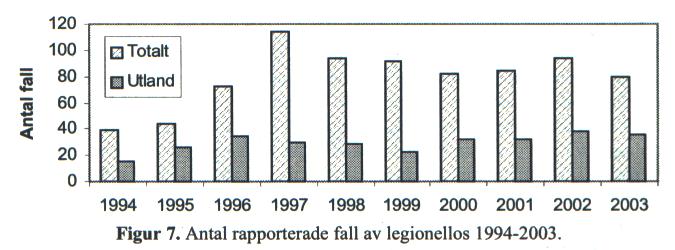
Antalet rapporterade fall av legionellos under 2003 har inte förändrats jämfört med tidigare år. Den årliga incidensen har varit ca 1/100 000 invånare, se figur 7. Majoriteten av de sjuka personerna har diagnostiserats med hjälp av urinantigentest som dock endast står för Legionella pneumophila serogrupp 1. Ett fall vardera har rapporterats av Legionella longbeachae och Legionella bozemanii, båda personerna smittade i Sverige.
Legionella utgör framför allt ett stort nosokomialt problem eftersom bakterierna ofta kan påvisas i sjukhusbyggnaders vattenledningssystem. För att hålla halten legionellabakterier på en låg nivå rekommenderar Socialstyrelsen att Boverkets normer för vattentemperaturer följs. Vattentemperaturen på utgående varmvatten från varmvattenberedaren ska då vara minst 60 °C och vattnet vid tappstället ska vara minst 50 °C. Dessutom bör ledningssystemen vara konstruerade så att stillastående vatten undviks och bakterietillväxt försvåras. På de flesta större sjukhus undersöks regelbundet halterna av legionellabakterier i vattnet. Detta sköts normalt av eller i samråd med vårdhygienpersonal. Vid höjda bakterienivåer i varmvattnet spolas vattenledningarna med hetvatten. Värt att notera är också att legionellabakterier är relativt toleranta mot klor! Vid prospektiva studier av sjukhusvårdade fall av legionellapneumoni uppskattade man en incidens på 2-6 % i Sverige. Dessa resultat tyder på en omfattande underrapportering (Bernander, Örtqvist, Darelid).
Något vaccin mot sjukdomen finns inte.
Totalt under 2003 kan 36 av 80 rapporterade fall betraktas som associerade med utlandsvistelse.
Papegojsjuka (ornithos) – Chlamydophila psittaci (uppdaterad maj 2012)[redigera]
Infektioner av C. psittaci uppträder som enstaka fall eller som mindre utbrott med gemensam smittkälla. Smittkälla kan vara t.ex. duvslag eller fågelfarmer liksom affärer för sällskapsdjur. Sekundärfall uppträder som regel inte. Papegojsjuka förekommer över hela världen. I Sverige rapporterades under 1980-talet omkring 100 fall årligen. Under det senaste årtiondet har mellan två och 24 fall anmälts per år. Det finns ingen uppenbar förklaring till denna minskning, men en möjlig orsak är att färre personer provtas för infektionen numera.
Vaccin saknas.
Q feber - Coxiella burnetii[redigera]
Q-feber är en vitt spridd zoonos. I Europa förekommer den sporadiskt. Seroprevalensen kan dock vara hög, upp till 40 % hos riskgrupper.
Ett stort antal olika djur infekteras. Huvudsaklig reservoar för infektion av människa är nötkreatur, får, get och i viss mån katt. Också fästingar kan vara smittade men anses ha liten betydelse för smittspridning. De flesta infekterade djur är utan symtom. Det är därför svårt att identifiera och skydda sig mot riskbesättningar. Sjukdomen blir också svår att utrota. Aktivering av latenta infektioner i livmoder och mjölkkörtlar kan ske under dräktighet och ge höga bakteriekoncentrationer i placenta och utsöndring via mjölk. Det finns anledning att ge akt på influensaliknande symtom som upp¬kommer i anslutning till förlossning eller slakt av sådana djur. Smitta sprids vid direkt kontakt, genom aerosoler, damm eller med produkter från djuren. Bakterien är mycket resistent mot uttorkning och lågt pH. Den kan därför överleva länge i miljön och spridas med dammpartiklar. Vanligen sker smittan utomlands. Vaccin finns men är inte tillgängligt i Sverige.
Övriga infektioner[redigera]
Chlamydophila pneumoniae[redigera]
Förekomsten av antikroppar mot C. pneumoniae i västvärlden är åldersberoende. Hos små barn påvisas en låg frekvens av sådana antikroppar. Frekvensen börjar sedan öka vid skolåldern och har sin snabbaste ökningstakt mellan 10-15 års ålder. Efter 20-års ålder sker en mera dämpad ökning med ca 10 % högre prevalens bland män än bland kvinnor. I vuxen ålder kan antikroppar således påvisas hos minst varannan person. Mönstret anses spegla expositionen i en befolkning över en längre tid. Longitudinella studier har också visat att incidensen av infektioner är högst vid 10-15 års ålder. Under epidemitider kan man notera ett ökat insjuknande även bland föräldragenerationen.
Landsomfattande utbrott under ett eller två år uppträder med intervall om 4-8 år. Kliniska fall uppträder främst under vinterhalvåret.
Mycoplasma pneumoniae[redigera]
M. pneumoniae-infektioner förekommer endemiskt men epidemiska toppar uppträder vart 4 – 7 år. Smittspridning inom familjer är vanlig men också på olika institutioner, skolor, sommarläger etc. Vid epidemier kan M. pneumoniae orsaka > 50 % av all samhällsförvärvad pneumoni. Infektionerna är vanligast i åldern 5 – 9 år (årlig incidens 4/1000), därefter drabbas vanligast individer i 10 – 14 års ålder (årlig incidens 3/1000). Hos vuxna är incidensen mindre väl kartlagd, men är sannolikt betydligt lägre. Hos vuxna orsakar M. pneumoniae i endemiska situationer endast några procent av samhällsförvärvade pneumonier. Hos yngre är motsvarande siffra ca 10 % och M. pneumoniae är därmed den efter pneumokocker vanligaste orsaken till samhällsförvärvad pneumoni.
Staphylococcus aureus – ej MRSA[redigera]
Bakterien är tålig och överlever höga salthalter, uttorkning och värme.
Människan blir koloniserad redan i nyföddhetsperioden med S. aureus. Den vanligaste ekologiska nischen är näsöppningen men den kan även förekomma perinealt, i ljumskar och fuktiga hudveck samt mer sällan på slemhinnor urogenitalt och i magtarmkanalen. Vissa kloner tycks ha potential att kolonisera även svalget (exempelvis vid MRSA-utbrottet på SU i Göteborg). Ungefär en tredjedel av normalbefolkningen är bärare; hos 60 % är bärarskapet intermittent medan 20 % aldrig blir bärare. Upp till 90 % av vårdpersonal kan vara bärare. Patienter med hudåkommor kan vara extrema spridare. Staphylococcus aureus orsakar hälften av alla infektioner i hud- och mjukdelar samt är den vanligaste patogena bakterien vid djupa septiska infektioner.
Aktinomykos[redigera]
Aktinomykos förekommer över hela världen men den verkliga incidensen är svår att uppskatta. Känsligheten för penicillin gör sannolikt att aktinomykos ses mindre ofta idag än tidigare.
Nokardios[redigera]
De aeroba aktinomyceterna är vanligt förekommande i jord.
Nokardios uppfattas som en i huvudsak samhällsförvärvad infektion. Det finns dock flera exempel på nosokomial anhopning av fall inom t.ex. transplantations- och hjärtkirurgisk verksamhet.
Sjukdomen är ovanlig men den sanna incidensen är okänd då den kliniska bilden liknar den vid andra infektioner såsom TB och den mikrobiologiska rutindiagnostiken inte är optimal för identifiering av Nocardiae.
Enterobacteriaceae[redigera]
Det är inte möjligt att ange säkra incidenssiffror för NLI orsakade av Enterobacteriaceae. Några få procent av samhällsförvärvad pneumoni orsakas av sådana bakterier, medan motsvarande siffror för nosokomial pneumoni är 40 – 60 %. Siffrorna varierar starkt mellan olika rapporter. Diagnostiska svårigheter torde bidra till detta. Omkring 10 % av nosokomiala pneumonier orsakas av Klebsiella och ca 6 % av E. coli. Varierande siffror anges för Enterobacter spp, incidensen tycks vara i paritet med den för E. coli. Serratia-pneumonier förekommer nästan uteslutande i vårdmiljö. Typiskt är infektionsutbrott där smittkällan kan vara nebulisatorer, trakealsugar som kontaminerats via förorenat vatten, intravaskulära katetrar och dylikt. Proteae är orsaken till nosokomial pneumoni i ca 2 % av dessa. Salmonella-pneumonier är ovanliga och förekommer mest i samband med S. Typhi- och S. Paratyphi-infektioner. Citrobacter ger upphov till sporadiska fall eller utbrott av nosokomiala infektioner inkluderande NLI.
Pseudomonas[redigera]
Ytterst få rapporter berör incidens av samhällsförvärvad P. aeruginosa-pneumoni. En rapport anger att ca 5 % av alla pneumonier på äldreboenden orsakas av denna mikroorganism. I huvudsak är P. aeruginosa-pneumoni en nosokomial infektion. På intensivvårdsavdelningar kan förekomsten vara ännu högre, upp till 40 %. En speciell ”mukoid” fenotyp av P. aeruginosa koloniserar 70-80 % av individer med cystisk fibros.
Burkholderia cepacia[redigera]
Mellan 3 och 5 % av CF-patienter koloniseras av B. cepacia. I epidemiska situationer på CF-centra kan upp till 30 % av patienterna koloniseras. Av de nio identifierade genomovarianterna av B. cepacia dominerar i kliniskt material variant III (85 % B. cenocepacia) och II (10 %, B. multivorans). Särskilt spridningsbenägen är variant III, som spridits klonalt från Kanada till europeiska CF-centra. Sannolikt utgör person till person-smitta huvudsaklig smittväg. Nosokomial spridning från IVA-vårdade CF-patienter till andra patienter på avdelningen finns beskrivet.
Stenotrophomonas maltophilia[redigera]
Mellan 5 och 25 % av CF-patienter på CF-enheter är koloniserade med S. maltophilia. Endast sällan förekommer patient till patientsmitta. I stället finns flera kloner samtidigt i sjukhusmiljön, speciellt i våtmiljöer, ventilatorer, nebulisatorer och dylikt.
Acinetobacter species[redigera]
Tarmfloran utgör reservoar för Acinetobacter och kan i ogynnsamma fall ge upphov till utbrott av nosokomiala infektioner. Hos sjukhusvårdade individer isoleras bakterien nästan lika ofta som Pseudomonas species från kliniska prov.
Anaeroba bakterier[redigera]
Anaeroba infektioner kan misstänkas vid lungabscess (anaerober i 85-95 %), nekrotiserande pneumoni, aspirationspneumoni, bronkiektasier, pleuraempyem samt mediastinit. Anaeroba bakterier är inte vanliga vid ordinära lunginflammationer. I ett obduktionsmaterial återfanns anaeroba bakterier i drygt 3 % av fallen.
Pneumocystis jiroveci pneumoni (PCP)[redigera]
P. jiroveci är vanligt förekommande och i de flesta fall har barn exponerats vid tre till fyra års ålder. Även om teorier som postulerar att sjukdomen orsakas av aktivering av en latent infektion har förekommit sedan länge visar nya data att återinfektion är en vanlig företeelse. Studier med känslig PCR-baserad detektion ger vid handen att exponering av immunkompetenta vuxna resulterar i en kortvarig kolonisation eller subklinisk infektion. Sjukdomen överförs troligen som luftburen smitta. Samlade data tyder dels på att person till person smitta lär äga rum dels på att späd- och småbarn kan utgöra tillfälliga reservoarer. Det är inte känt huruvida en omgivningsreservoar existerar. Profylax har reducerat incidensen av PCP. De vanligaste preparaten vid prevention är trimetoprim-sulfa (peroralt) som förstavalsalternativ och nebuliserad pentamidine.
Virus[redigera]
De flesta luftvägsvirus sprids genom droppsmitta eller, ofta effektivare, genom inokulation. Vid hosta och nysningar sprayas föremål med virusinnehållande droppar och aerosol. Virus blir liggande på diverse ytor, och kan behålla sin infektivitet i flera timmar. Om man vidrör kontaminerade ytor och sedan slemhinnor i näsa, mun eller öga inokuleras exempelvis RSV och parainfluensa mycket effektivt. Influensa smittar även luftburet, och kan hålla sig svävande ganska länge på små partiklar i luften. Graden av virussjukdom korrelerar ofta till mängden virus i luftvägarna, och därför sprider man smitta effektiver ju sjukare man är. Risken att insjukna ökar också med smittdosen, speciellt om man har en partiell immunitet efter tidigare genomgången infektion. Om man kan hålla ett visst avstånd till sjuka personer, tvätta händerna ofta och undvika självinokulation kan man minska smittdosen och därmed risken att bli sjuk.
Virus som orsakar luftvägsinfektioner smittar effektivt. De flesta barn har haft RS-, parainfluensa- adenovirus- och metapneumovirusinfektioner samt någon influensa under de första levnadsåren. RS och parainfluensainfektioner ger inte bestående immunitet, och influensavirus förändras ständigt. Därför kan man få flera infektioner med dessa virus genom livet. Spädbarn och de riktigt gamla är, förutom hjärt –lungsjuka, de som oftast får infektion i nedre luftvägarna när de smittas av dessa virus. Hos vuxna som återinfekteras blir symtomen milda. Det är viktigt att komma ihåg, att snuva hos en vuxen kan ge en livshotande RS-virusinfektion hos ett spädbarn. På samma sätt kan en mild influensa hos ett barn ge en livshotande sjudom hos en äldre. Man bör därför undvika att utsätta personer som hör till riskgrupp för svår luftvägssjukdom för smittorisk vid influensa eller RSV, även om man har obetydliga luftvägssymtom. Beträffande speciell epidemiologi, se under respektive virus.