Gonorré-laboratoriediagnostik
Huvudartikel: Gonorré
Bakgrund[redigera]
Gonorré (såväl symtomatisk som asymtomatisk) måste för definitiv laboratoriediagnos konfirmeras genom isolering av N. gonorrhoeae (gonokocker, GC) genom odling (referensmetod), detektion av specifikt antigen eller specifik nukleinsyra i kliniska prov alternativt mikroskopisk identifiering av karakteristiska gramnegativa intracellulära diplokocker i polymorfnukleära leukocyter (PMNL) i utstryk av kliniska prover. Observera dock att mikroskopisk identifiering bara kan ge definitiv laboratoriediagnos för uretrautstryk från symtomatiska män på grund av, för andra provtyper, suboptimal sensitivitet och även i många fall suboptimal specificitet. Sålunda har metoden >90 % sensitivitet för uretrautstryk från symtomatiska män men endast 50-75 % sensitivitet hos asymtomatiska män och 30-50 % sensitivitet (80-95 % specificitet) för cervikala utstryk från kvinnor. Korrekt provtyp, provtagning, färgning och undersökning, inklusive tolkning av erfaren mikroskopist är kritiskt.
Odling är referensmetod på grund av dess höga specificitet och sensitivitet, möjlighet att analysera alla provtyper samt utföra resistensbestämning och annan karakterisering. Optimerade provtagnings-, transport- och odlingsbetingelser är nödvändiga. I ett svenskt perspektiv, med relativt låg gonorréprevalens, är rutindiagnostik baserad enbart på direktmikroskopi eller DNA/RNA-baserade metoder ej tillfyllest. För screening av vissa riskgrupper, användning i högprevalenta populationer eller i utvecklingsländer med problem avseende provtransport och/eller odling kan dock DNA/RNA-baserade metoder vara användbara.
Referensmetodik[redigera]
Odling[redigera]
Odling är referensmetod för isolering av N. gonorrhoeae från alla typer av kliniska prov.
Referenssubstrat Primärisolering av gonokocker från kliniska prov görs på två identiska substrat där det ena gjorts selektivt genom antibiotikatillsats (se bilaga 1). Prover från uretra, cervix och extragenitala mer sterila lokaler som konjunktiva, led, blod etc. inokuleras på både selektivt och icke-selektivt odlingsmedium. Prover från rektum och farynx inokuleras enbart på selektivt substrat.
Isolering Inokulerade plattor inkuberas snarast i CO2-termostat (5+-1 % CO2-anrikad fuktig atmosfär, 36+-1 °C) i 2 dygn, med granskning efter 1 dygn.
Identifiering och minimikriterier[redigera]
Inkubering 1 dygn: Karakteristiska gonokockkolonier, vilka kan variera i färg, storlek och morfologi, analyseras för produktion av oxidas. Material från snabbt oxidas-positiva kolonier gramfärgas och renodlas idealt på selektivt och icke-selektivt substrat. Inkubering av renodlingsplattor och primärplattan ytterligare 24 timmar.
Inkubering 2 dygn: Eventuella nyidentifierade gonokockkolonier analyseras som ovan. Utför analyser av renodlade gonokocker för definitiv specieskonfirmering (biokemisk karakterisering och antigendetektion enligt nedan) och bestämning av antibiotikakänslighet. Negativa odlingar kan svaras ut.
Presumtiv diagnos: Typiska gonokockkolonier är snabbt oxidas-positiva, växer på selektivt odlingsmedium, och består av karakteristiska gramnegativa diplokocker.
Definitiv diagnos: Presumtiv diagnos (se ovan) samt utförd specieskonfirmering är nödvändig för att kunna förse med en definitiv laboratoriediagnos. Optimalt används åtminstone två metoder baserade på skilda principer för en hög sensitivitet och specificitet (1, 2). Problemstammar bör sändas till referenslaboratoriet för utförlig specieskonfirmering och vidare karakterisering.
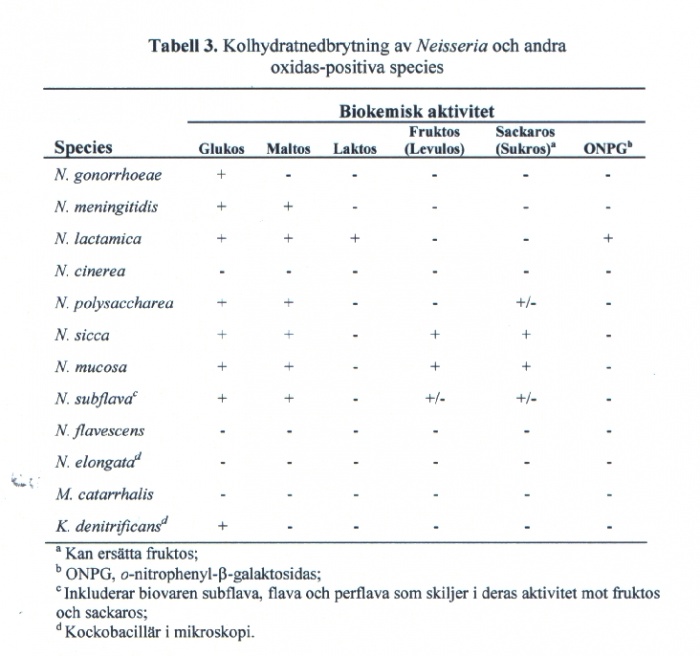
Biokemisk karakterisering: Referenspanel för biokemisk specieskonfirmering anges i Tabell 3 och omfattar glukos (nedbrytning genererar syraproduktion), maltos, fruktos eller sackaros, och laktos (t.ex. ONPG-test). Denna diagnostik kompletteras med kommersiell metod för påvisande av gonokockantigen (Phadebact Monoclonal GC Test (Bactus AB)), vilken också ger isolatets serogrupp (WI [PorB1a] eller WII/III [PorB1b]).
Kolhydratnedbrytning kan analyseras med tillväxtberoende (på odlingsplatta; 1 dygn) eller tillväxtoberoende metod (i buljong; 4 h). Inokulation med rena, färska kolonier från renodlingsplatta (utan andra organismer eller inhiberande kontaminanter) och användning av höggradigt renat kolhydrat är kritiskt. Referensmedium och rekommenderade kvalitetskontroller enligt bilaga 1.
Observera att det förekommer N. gonorrhoeae- och N. meningitidis-stammar med ej detekterbar nedbrytning av glukos. N. meningitidis stammar med ej detekterbar nedbrytning av maltos och N. cinerea stammar med detekterad glukosnedbrytning (framförallt i snabbtester) kan även förekomma. Kingella denitrificans, som är kockobacillär, kan förväxlas med gonokocker. Testning för påvisande av gonokockantigen bör därför också utföras.
Antigendetektion[redigera]
Phadebact Monoclonal GC Test påvisar antigen baserat på coagglutination med specifika monoklonala antikroppar riktade mot PorB hos gonokocker. Metoden har mycket hög sensitivitet och specificitet, men enstaka falskt negativa gonokockisolat samt falskt positiva isolat av N. meningitidis, N. lactamica, N. cinerea, och K. denitrificans har rapporterats internationellt, framförallt med tidigare versioner av metoden. Strikt följsamhet till tillverkarens anvisningar är kritiskt.
Kommersiella och alternativa specieskonfirmerande tester[redigera]
Flera kommersiella tester finns tillgängliga för analys av kolhydratnedbrytning och annan biokemisk aktivitet för specieskonfirmering inom genus Neisseria. Exempel på sådana är API-NH, RapID NH liksom identifiering med hjälp av kromogena substrat och andra tester som identifierar aktivitet hos specifika enzymer med diskar/tabletter (Neisseria PET). Metoderna har varierande sensitivitet och specificitet varför specieskonfirmering baserad enbart på dessa inte rekommenderas (1, 2). Flera av metoderna förutsätter att alla gonokockstammar uttrycker enzymet prolyliminopeptidas (PIP). Senaste åren har en global spriding av minst en PIP-negativ gonokockstam identifierats (2), med resulterande svårighet att specieskonfirmera med dessa tester (1, 2).
Kommersiella immunologiska tester baserade på fluorescensmärkta antikroppar liksom DNA/RNA-baserade metoder för specieskonfirmering finns tillgängliga. Dessa har varierande sensitivitet och specificitet. Information om tillgängliga produkters prestanda och kvalitet kan lämnas av referenslaboratoriet.
Övriga diagnostiska metoder[redigera]
Nukleinsyrabaserade metoder[redigera]
Många kommersiella DNA/RNA-baserade metoder för diagnostik av N. gonorrhoeae har utvecklats under de senaste decennierna. Dessa är baserade på probe-hybridisering med specifika N. gonorrhoeae sekvenser, t.ex. Pace 2 (Gen-Probe) och Digene Hybrid Capture 2 (HC2) CT/NG (Digene Corporation), eller amplifiering av specifika nukleinsyrasekvenser, t.ex. Cobas Amplicor eller Cobas TaqMan48 (Roche Diagnostics), BD ProbeTec ET (Becton Dickinson), Aptima Combo 2 (Gen-Probe), Abbott m2000 (Abbott Laboratories) etc. Framförallt de amplifierande metoderna har hög sensitivitet och i flera fall relativt hög specificitet samt ger fördelar som möjlighet till icke-invasiv provtagning (t.ex. urin), snabbare diagnos, automatisering, ej behov av viabla bakterier, och samtidig detektion av både N. gonorrhoeae och Chlamydia trachomatis. Bland nackdelarna märks speciellt att de flesta av metoderna har suboptimal specificitet (sekvenslikheter med framförallt apatogena Neisseria arter i normalfloran och hög grad av interspecies genetisk överföring), effektiva och godkända protokoll för extragenitala prover saknas och undersökning av antibiotikaresistens kan inte utföras (3-9). Aptima Combo 2 (Gen-Probe) och Abbott m2000 (Abbott Laboratories) utmärker sig dock genom att dessa system har en avsevärt högre specifitet. Genetiska analyser för att identifiera alla viktiga antibiotikaresistens mekanismer existerar ej.
Flera in-house diagnostiska metoder har också utvecklats och två metoder baserade på detektion av porA pseudogenen hos N. gonorrhoeae har också hittills visat 100 % specificitet (6-8). Vid användning av amplifierande tester som ej har 100 % specificitet i ett lågprevalent land som Sverige bör man konfirmera alla positiva prover med annan test, dvs. idealt odling eller åtminstone genetisk test med annan målgen. Exempelvis, vid en prevalens av 2 % (fortfarande hög) och med en sensitivitet på 99 % och en specificitet på 99 % blir det positiva prediktiva värdet (PPV) endast 66,9 % (6, 9). Sålunda, i Sverige med mycket lägre gonorréprevalens, blir PPV ännu lägre.
Serologi (antikroppsbestämning)[redigera]
Komplementbindnings reaktion (KBR) med helcellsantigen av värmebehandlade N. gonorrhoeae samt hemagglutination eller ELISA med piliantigen är utvecklade in-house metoder för att påvisa antikroppar mot gonokocker. Effektiva, kommersiella metoder saknas dock.
Påvisande av antikroppar mot gonokocker i serum är av tveksamt diagnostiskt värde vid okomplicerad gonorré på grund av suboptimal sensitivitet och specificitet samt oförmåga att skilja aktiv från tidigare genomgången infektion. Vid kvarstående misstanke om djup komplikation eller disseminerad gonokockinfektion (DGI), som ej kunnat konfirmeras genom odling, kan den dock vara av värde framförallt om man kan påvisa signifikant titerförändring (~2 titersteg) vid analys av parade sera.
Antigendetektion med immunofluorescens eller enzymimmunologisk metodik (EIA/ELISA). För diagnostiskt bruk har dessa metoder ej tillräckligt hög prestanda.
Resistensbestämning[redigera]
Resistensbestämning av gonokocker erbjuder särskilda problem i val av medier, standardisering, kvalitetskontroll och tolkning av resultat. Endast laboratorier med särskilt intresse för N. gonorrhoeae bör utföra grundlig resistensbestämning. Agarspädningsmetod för MIC-bestämning är fortfarande internationell referensmetod. Metoden är dock mindre väl lämpad som rutinmetod. Etest (Biodisk AB) kan användas som alternativ för rutinmässig resistensbestämning och har visats ha jämförbara prestanda med referensmetoden.
På referenslaboratoriet utförs rutinmässigt resistensbestämning (Etest) mot ampicillin, cefixim, ceftriaxon, azitromycin, ciprofloxacin samt spektinomycin. Vid behov analyseras även andra antibiotika. Betalaktamas-produktion identifieras med nitrocefin disk. Ökande resistens mot de flesta tillgängliga antibiotika är ett globalt problem och resistensen visar på geografiska samt temporala variationer, varför det är nödvändigt att samtliga isolat i Sverige resistensbestäms. Den aktuella resistenssituationen för N. gonorrhoeae i Sverige, beskrivning av substratrecept och metodik för resistensbestämning liksom MIC-brytpunkter för SIR-klassifikation beskrivs av referenslaboratoriet och svenska Referensgruppen för antibiotikafrågor - metodgruppen, RAF-M.
Epidemiologisk typning[redigera]
N. gonorrhoeae har traditionellt karakteriserats med fenotypiska metoder som auxotypning (baserad på skilda näringsbehov), antibiogram, samt serogruppering och serovarbestämning (skilda antigena epitoper hos PorB). De serologiska metoderna för epidemiologisk typning är snabba, praktiskt enkla och kostnadseffektiva. Metoderna har dock svagheter som subjektivitet, suboptimal diskriminerande förmåga och tveksam reproducerbarhet. Därför har genetiska metoder utvecklats som kan identifiera skillnader i olika enzymer eller plasmider, enstaka eller multipla genetiska lokus (genom exempelvis sekvensering av framförallt specifika högvariabla gener), eller potentiellt indexera hela genomet hos gonokockstammar (med exempelvis pulsfält gelelektrofores, PFGE). Serovarbestämning som primär epidemiologisk markör med efterföljande sekvensering av väl valda högvariabla gener, exempelvis med metoden N. gonorrhoeae multiantigen sequence typing (NG-MAST), ger utmärkt information avseende korttidsepidemiologi. NG-MAST sekvenserar variabla delar av generna för två skilda yttermembranproteiner, PorB och TbpB, och metoden har en hög diskriminerande förmåga, objektivitet, reproducerbarhet, typningsbarhet samt generar data som kan användas för jämförelser mellan laboratorier (2, 4). På referenslaboratoriet används rutinmässigt serologisk karakterisering och vid specifika epidemiologiska frågeställningar eller i forskningssyften, många olika genetiska typningsmetoder. De specifika epidemiologiska frågeställningarna vägleder valet av typningsmetod(er).
Kvalitetskontroll med bilaga 1[redigera]
- Se Bilaga 1
Svarsrutiner[redigera]
Isolat som det enskilda laboratoriet identifierat som N. gonorrhoeae svaras växt av Neisseria gonorrhoeae, med tillägg att isolatet har skickats till referenslaboratoriet för definitiv diagnos och/eller vidare karakterisering och resistensbestämning.
Slutligt svar ges i förekommande fall efter verifiering, vidare karakterisering (serovarbestäming) och resistensbestämning på referenslaboratoriet. I svaret bör anges att gonorré är anmälningspliktigt enligt smittskyddslagen.
Laboratorierapportering[redigera]
Gonorré är anmälningspliktig enligt smittskyddslagen (2004:168). Anmälan av varje fall görs till lokal smittskyddsläkare samt till Folkhälsomyndigheten via SmiNet (http://www.sminet.se). Av behandlande läkare görs också en klinisk anmälan av varje enskilt fall till smittskyddsläkare och Folkhälsomyndigheten.
Referenslaboratorium[redigera]
Nationella referenslaboratoriet för patogena Neisseria, Kliniskt mikrobiologiska kliniken, Universitetssjukhuset Örebro, 701 85 Örebro. Kontaktpersoner: Docent Magnus Unemo och docent Hans Fredlund.
REFERENSER[redigera]
- 1. Alexander, S., and C. Ison. Evaluation of commercial kits for the identification of Neisseria gonorrhoeae. J. Med. Microbiol. 2005; 54:827-831.
- 2. Unemo, M., H. M. Palmer, T. Blackmore, G. Herrera, H. Fredlund, A. Limnios, N. Nguyen, and J. Tapsall. Global transmission of prolyliminopeptidase (PIP)-negative Neisseria gonorrhoeae strains – implications for changes in diagnostic strategies? Sex. Transm. Infect. 2007; 83:47-51.
- 3. Cook, R. L., S. L. Hutchison, L. Ostergaard, R. S. Braithwaite, and R. B. Ness. Systematic review: noninvasive testing for Chlamydia trachomatis and Neisseria gonorrhoeae. Ann. Intern Med. 2005; 142:914-925.
- 4. Fredlund, H., L. Falk, M. Jurstrand, and M. Unemo. Molecular genetic methods for diagnosis and characterisation of Chlamydia trachomatis and Neisseria gonorrhoeae: impact on epidemiological surveillance and interventions. APMIS. 2004; 112:771-784.
- 5. Palmer, H. M., H. Mallinson, R. L. Wood, and A. J. Herring. Evaluation of the specificities of five DNA amplification methods for the detection of Neisseria gonorrhoeae. J. Clin. Microbiol. 2003; 41:835-837.
- 6. Whiley, D. M., J. W. Tapsall, and T. P. Sloots. Nucleic acid amplification testing for Neisseria gonorrhoeae: an ongoing challenge. J. Mol. Diagn. 2006; 8:3-15.
- 7. Hjelmevoll, S. O., M. E. Olsen, J. U. Sollid, H. Haaheim, M. Unemo, and V. Skogen. A fast real-time polymerase chain reaction method for sensitive and specific detection of the Neisseria gonorrhoeae porA pseudogene. J. Mol. Diagn. 2006; 8:574-581.
- 8. Hjelmevoll, S. O., M. E. Olsen, J. U. Ericson Sollid, H. Haaheim, K. K. Melby, H. Moi, M. Unemo, and V. Skogen. 2008. Clinical validation of a real-time polymerase chain reaction detection of Neisseria gonorrhoeae porA pseudogene versus culture technique. Sex. Transm. Dis. 2008; 35:517-520.
- 9. Savicheva, A., E. Sokolovsky, N. Frigo, T. Priputnevich, T. Brilene, J. Deák, R. Ballard, C. Ison, A. Hallén, M. Domeika, and M. Unemo. Guidelines for laboratory diagnosis of Neisseria gonorrhoeae in East-European countries. Part 2. Culture, non-culture methods, determination of antibiotic resistance, and quality assurance. Acta. Medica Lituanica. 2007; 14:123-134.
- 10. Bignell, C. J.; European branch of the International Union against Sexually Transmitted Infection and the European Office of the World Health Organization. European guideline for the management of gonorrhoea. Int. J. STD. AIDS. 2001; 12 (suppl 3):P27-29.
- 11. Janda W. M., and C. A. Gaydos. 2007. Neisseria, p. 601-620. In Murray PR, Baron EJ, Jorgensen JH, Landry ML, and Pfaller MA (eds.). Manual of clinical microbiology, 9th ed., vol. 1. ASM Press, Washington, D.C., USA.
- 12. Sexually Transmitted Diseases. 2007. 4th edition, Holmes KK, Sparling PF, Stamm WE, Piot P, Wasserheit JN, Corey L, Cohen MS, Watts DH (eds.). McGraw-Hill Professional, New York, USA.
- 13. Van Dyck, E., A. Z. Meheus, and P. Piot. Gonorrhoea. In: Laboratory diagnosis of sexually transmitted diseases. World Health Organization (WHO), Geneva; 1999:1-21.