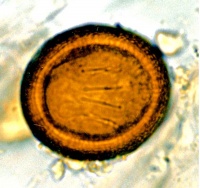
Taenia saginata
Huvudartikel, publicerad mars 2012.
Till innehållförteckningen för Referensmetodik:Parasitologisk diagnostik
Taenia saginata (obeväpnad bandmask, nötbandmask)[redigera]
Smittämne[redigera]
Den vuxna masken är den största parasit som infekterar människa. Den blir oftast mellan 5–10 meter lång, men även 20 meter långa maskar har uppmätts. Huvudet (scolex) är päronformat, med fyra sugskålar och saknar hakar. Gravida segment innehåller ägg som är mikroskopiskt identiska med Taenia solium och T. asiatica-ägg.
Livscykel[redigera]
Människan (definitiv värd) infekteras endast vid förtäring av rått eller otillräckligt upphettat nötkött som innehåller inkapslade larver (cysticerci, dynt). Observera att T. saginata-ägg inte är infektiösa för människa. Dynt-väggen upplöses i tunntarmen och larven frigörs. Den fäster sig vid tarmväggen med hjälp av fyra sugskålar. Utveckling till en vuxen bandmask tar cirka 3 månader. Äggfyllda masksegment kan aktivt förflytta sig ut genom anus. Nötkreatur (mellanvärd) infekteras vid förtäring av segment, ofta tillsammans med gräs eller hö. Larver frigörs från äggen av det infekterade djurets matsmältningsenzymer, penetrerar tunntarmens vägg och förs med blod och lymfa ut i kroppen, tills de når tvärstrimmig muskultur och där utvecklas till dynt. Denna utveckling tar 10–12 veckor eller längre och dynten förblir infektiösa i åratal innan de förkalkas. Dynten mäter cirka 8 x 5 mm, är äggformade, vita, vätskefyllda och innehåller en protoscolex (en larv försedd med sugskålar).
Symtom och klinisk bild[redigera]
Den vuxna masken orsakar i de flesta fall ingen skada på tarmväggen, dock kan inflammation ibland förekomma. De flesta infektioner förlöper symtomfritt. Oftast är det enda tecknet på infektion närvaro av aktiva segment i feces. Vid symtomatisk infektion förekommer buksmärtor, illamående och kräkningar.
Epidemiologi[redigera]
Infektionen är kosmopolitisk och förekommer i nästan alla länder där kött äts rått eller otillräckligt upphettat. I Sverige påvisas årligen några hundratals fall av parasiten vid köttbesiktning av slaktdjur (ref. 7) Bland veterinärerna kallas larven i nötmuskulatur för cysticercus bovis.
Provtagning och transport[redigera]
Provmaterial[redigera]
Fecesprov och/eller segment
Provtagning[redigera]
Förvaring/transport[redigera]
Inga speciella krav
Laboratoriediagnostik[redigera]
Allmänt[redigera]
Laboratoriediagnostik av Taenia till genusnivå är baserad på mikroskopi av ägg eller segment. Tidigare var även artbestämning baserad på morfologiska skillnader mellan masksegment (T. saginata och T. solium). Med upptäckten av en tredje Taenia-art (T. asiatica), som också kan infektera människa men inte skiljas morfologisk från de andra två arterna, rekommenderas molekylärbiologisk teknik för artbestämning. T. solium är klassificerad som en riskklass 3** agens av Arbetsmiljöverket (AFS 2005:1). Ofixerat material, som innehåller levande ägg, bör hanteras försiktigt eftersom T. solium ägg är infektiösa för människa och kan orsaka cysticerkos.
Serologiska tester saknar betydelse vid diagnostik av tarminfektion med vuxen Taenia-mask.
Referensmetod[redigera]
Påvisning av Taenia-ägg i preparat från feces efter formalin/etylacetatkoncentrering (PAR 01). Äggen från alla tre Taenia-arterna är morfologiskt oskiljaktiga. Undersökning av gravida segment kan ge information om genustillhörighet, men har begränsat värde för artbestämning (se ovan).
Avläsningskriterier[redigera]
Taenia-ägg är runda, har en tjock, skal med radiära stråk och mäter 31–43 µm. Ägget innehåller en larv som är försedd med hakar. T. saginata-segment kan aktivt förflytta sig i ofixerad feces. Det mäter 20 x 7 mm och dess uterus har 15–20 sidoförgreningar. T. solium-segment mäter 11 x 5 mm och uterus har 7–13 sidoförgreningar. T. asiatica-segment mäter 12 x 5 mm och uterus har 16–21 sidoförgreningar.
Artbestämning[redigera]
Differentiering mellanolika Taenia-arter och påvisning av subgenotyper av T. solium (amerikansk/afrikansk och asiatisk) görs med DNA från ägg eller masksegment och molekylära metoder. Flera metoder finns beskrivna: PCR-RFLP, SSCP, RAPD-PCR (se sammanfattning i ref 4 och 5).
Kvalitetssäkring[redigera]
Taenia-ägg ingår i UK-NEQAS feces-utskick.
Svarsrutiner för mikroskopi[redigera]
Taenia spp. ägg påvisade/Inga maskägg påvisade
Taenia spp. segment påvisade
Svarsrutiner för PCR[redigera]
DNA från Taenia (ange art) ägg/segment påvisade.
Övriga diagnostiska metoder[redigera]
- ELISA för påvisning av parasit-antigen i feces.
- PCR för identifiering av parasit-DNA i feces. En multiplex PCR med kopro-DNA har testats med lovande resultat: hög känslighet (5–50 ägg/gram feces), art- och genotyp-specificitet och möjlighet att påvisa infektion i prepatent stadium(ref. 3).
- Eupral-behandling av segment för visualisering av uterusförgreningar (ref. 8)
Laboratorierapportering[redigera]
Infektion med Taenia spp. är inte anmälningspliktig enligt smittskyddslagen. Vid misstanke om inhemsk av T. solium-smitta är det viktigt att lokal smittskyddsenhet kontaktas.
Litteraturhänvisningar[redigera]
1. Raether W. Hänel H. Epidemiology, clinical manifestations and diagnosis of zoonotic cestode infections: an update. Parasitol Res. 2003; 91:412-438.
2. Allan JC. Wilkins PP. Tsang VC. Craig PS. Immunodiagnostic tools for taeniasis. Acta Trop. 2003; 87:87-93.
3. Yamasaki H, Nakao M, Sako Y, Nakaya K, Sato MO, Ito A. Mitochondrial DNA diagnosis for taeniasis and cysticercosis. Parasitol Int. 2006;55 Suppl:S81-5. Review.
4. Yamasaki H, Allan JC, Sato MO, Nakao M, Sako Y, Nakaya K, Qiu D, Mamuti W, Craig PS, Ito A. DNA differential diagnosis of taeniasis and cysticercosis by multiplex PCR. J Clin Microbiol. 2004 Feb;42(2):548-53.
5. Yamasaki H, Sato MO, Sako Y, Nakao M, Nakaya K, Mamuti W, Craig PS, Margono SS, Ito A. Cysticercosis/taeniasis: recent advances in serological and molecular diagnoses. Southeast Asian J Trop Med Public Health. 2003;34 Suppl 2:98-102.
6. McManus DP. Molecular discrimination of taeniid cestodes. Parasitol Int. 2006;55 Suppl:S31-7.Review.
7. http://www.vaxteko.nu/html/sll/sjv/utan_serietitel_sjv/UST94-1/UST94-1R.HTM
8. Ash L, Orihel T. Atlas of Human Parasitology. ASCP Press, Chicago