Skillnad mellan versioner av "Kromogena substrat"
| Rad 20: | Rad 20: | ||
===Användningsområden för kromogena substrat inom klinisk mikrobiologi=== | ===Användningsområden för kromogena substrat inom klinisk mikrobiologi=== | ||
| − | ====Urinodlingar==== | + | ====Urinodlingar==== |
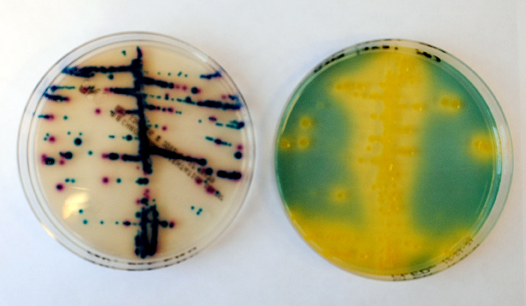
| − | Ett antal fasta kromogena substrat marknadsförs som alternativ till gängse odlingssubstrat (CLED-, blod-, McConkey-agar). Kombinationen blodagar och [[Urin-bilaga 1|kromogena substrat]] torde ge likvärdiga diagnostiska prestanda som kombinationen blod- och CLED-agar ([[Kvantitativ urinodling-hög rutinnivå (Nivå 2)]]). De kromogena substaten medger direkt presumtiv identifiering av ''E. coli, Klebsiella/Enterobacter/Serratia, Proteus/Morganella/Providencia'' och enterokocker. Med vissa fabrikat kan också ''S. saprophyticus'' identifieras presumtivt. Övriga grampositiva bakterier växer ofta sämre och ungefär som på CLED-agar. Specificiteten för identifiering av ''E. coli, P. mirabilis'' och enterokocker är allmänt hög oavsett fabrikat. | + | [[Fil:Kromagar CLED_2.jpg|thumb|right|700px| Bakterieväxt på Kromagar avsedd för urin jämfört med CLED-agar. ''Foto Camilla Svensson'']] |
| + | |||
| + | Ett antal fasta kromogena substrat marknadsförs som alternativ till gängse odlingssubstrat (CLED-, blod-, McConkey-agar). Kombinationen blodagar och [[Urin-bilaga 1|kromogena substrat]] torde ge likvärdiga diagnostiska prestanda som kombinationen blod- och CLED-agar ([[Kvantitativ urinodling-hög rutinnivå (Nivå 2)]]). De kromogena substaten medger direkt presumtiv identifiering av ''E. coli, Klebsiella/Enterobacter/Serratia, Proteus/Morganella/Providencia'' och enterokocker. Med vissa fabrikat kan också ''S. saprophyticus'' identifieras presumtivt. Övriga grampositiva bakterier växer ofta sämre och ungefär som på CLED-agar. Specificiteten för identifiering av ''E. coli, P. mirabilis'' och enterokocker är allmänt hög oavsett fabrikat. | ||
| Rad 27: | Rad 29: | ||
| − | I en studie publicerad 2002 (Aspevall et al) jämfördes referenssubstraten CLED, blod-agar och McConkey-agar, mot fyra kommersiella kromogena substrat (Chromagar Orientation från BBL, CHROMagar Orientation, CHROMagar, Chromogenic UTI Medium, Oxoid, och CPS ID, bioMérieux). Studien omfattade 1200 urinprov med totalt 420 kliniskt relevanta bakteriella isolat som bedömdes som kliniskt relevanta. Växten på de kromogena substraten var i nivå med referenssubstraten såväl kvantitativt som kvalitativt; efter ett dygn växte 99-100 % av isolaten på referenssubstraten mot 97-99 % på de kromogena. Efter 2 dygns inkubering var skillnaderna i växt i huvudsak kvar. I studien konstaterades att några av enterokockisolaten i blandkulturer bara kunde identifieras på de kromogena substraten och att antalet jästisoleringar blev färre med dessa substrat. Jämfört med standarddiagnostiska metoder identifierades ''E. coli'' korrekt i 95-99 % av fallen på de kromogena substraten, men ett av 5 ''Citrobacter'' species identifierades som ''E. coli''. Författarna konkluderade att kromogena substrat kan användas som ensamt alternativ till CLED-agar ([[Kvantitativ urinodling-låg rutinnivå (screening, Nivå 1)]]) för isolering av uropatogener. | + | I en studie publicerad 2002 (Aspevall et al) jämfördes referenssubstraten CLED, blod-agar och McConkey-agar, mot fyra kommersiella kromogena substrat (Chromagar Orientation från BBL, CHROMagar Orientation, CHROMagar, Chromogenic UTI Medium, Oxoid, och CPS ID, bioMérieux). Studien omfattade 1200 urinprov med totalt 420 kliniskt relevanta bakteriella isolat som bedömdes som kliniskt relevanta. Växten på de kromogena substraten var i nivå med referenssubstraten såväl kvantitativt som kvalitativt; efter ett dygn växte 99-100 % av isolaten på referenssubstraten mot 97-99 % på de kromogena. Efter 2 dygns inkubering var skillnaderna i växt i huvudsak kvar. I studien konstaterades att några av enterokockisolaten i blandkulturer bara kunde identifieras på de kromogena substraten och att antalet jästisoleringar blev färre med dessa substrat. Jämfört med standarddiagnostiska metoder identifierades ''E. coli'' korrekt i 95-99 % av fallen på de kromogena substraten, men ett av 5 ''Citrobacter'' species identifierades som ''E. coli''. Författarna konkluderade att kromogena substrat kan användas som ensamt alternativ till CLED-agar ([[Kvantitativ urinodling-låg rutinnivå (screening, Nivå 1)]]) för isolering av uropatogener. |
| − | I en studie av Whittier och Della-Latta (2005) jämfördes resultat av odling av 785 urinprov på ett biplattsystem (blod/MacConkey) mot odling på Chromagar Orientation (BBL). Identiska positiva odlingsresultat erhölls i 355 prov, medan olika resultat erhölls i 21 fall (2,7 %). I endast sex av dessa bedömdes skillnaderna ha klinisk betydelse (blandfloror där man endast med kromagarn identifierade växt av enterokocker). Mellan 43 och 44 % (materialet åldersstratifierat) av resultaten på kromagar hade kunnat rapporteras direkt utan vidare testningar. Författarna konstaterade att nyttan med kromagar framförallt var att lättare kunna identifiera målbakterier i blandfloror och att direkt identifiering av vissa bakterier (främst ''E. coli'' och enterokocker) kunde bidra till minskat behov av verifierande biokemiska tester. | + | I en studie av Whittier och Della-Latta (2005) jämfördes resultat av odling av 785 urinprov på ett biplattsystem (blod/MacConkey) mot odling på Chromagar Orientation (BBL). Identiska positiva odlingsresultat erhölls i 355 prov, medan olika resultat erhölls i 21 fall (2,7 %). I endast sex av dessa bedömdes skillnaderna ha klinisk betydelse (blandfloror där man endast med kromagarn identifierade växt av enterokocker). Mellan 43 och 44 % (materialet åldersstratifierat) av resultaten på kromagar hade kunnat rapporteras direkt utan vidare testningar. Författarna konstaterade att nyttan med kromagar framförallt var att lättare kunna identifiera målbakterier i blandfloror och att direkt identifiering av vissa bakterier (främst ''E. coli'' och enterokocker) kunde bidra till minskat behov av verifierande biokemiska tester. |
| − | + | ||
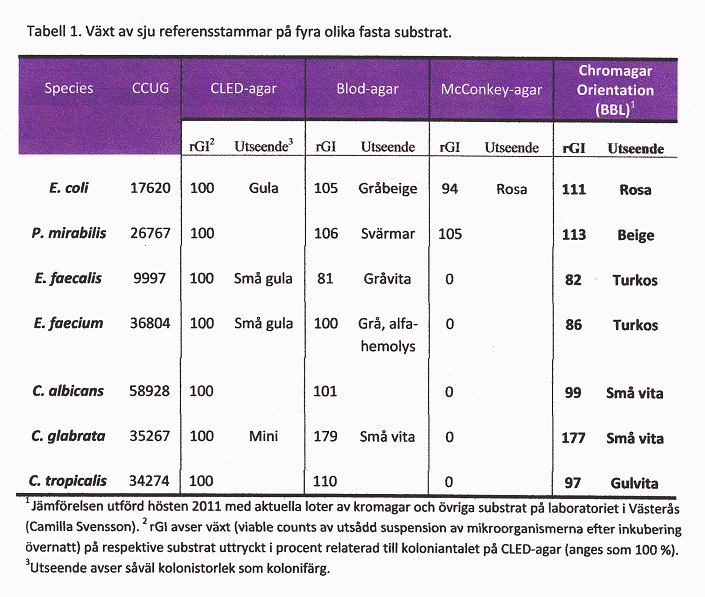
I '''tabell 1''' visas växtsätt för sju olika referensstammar (bakterier och svamp) på tre standardsubstrat och Chromagar Orientation agar (BBL). Som framgår av tabellen var den prövade loten av kromagarn i stort sett likvärdig med referenssubstratet (CLED-agar). Ett av jästsvampisolaten växte bättre på kromagar än CLED, men enterokockerna något sämre. I en annan in vitro-prövning utförd i Västerås (2009) jämfördes CPS ID (bioMèrieux) mot CLED med 10 CCUG-stammar (presumtiva målbakterier för urinvägsdiagnostiken) beträffande växt (koloniantal, kolonistorlek, koloniutseende) och kolonifärg. ''E. faecalis'' växte genomgående med nära dubbla koloniantalet på det kromogena substratet jämfört med CLED. ''Staphylococcus aureus'' och ''Streptococcus agalactiae'' växte med mycket små kolonier, övriga (''E. coli, Klebsiella, Acinetobacter, Pseudomonas'') med medelstora eller stora kolonier. Färgomslagen överensstämde genomgående med fabrikantens beskrivningar. Resultaten av dessa jämförelser illustrerar vikten av att vid upphandling jämföra olika fabrikat av kromagar mot varandra och också mot referenssubstrat (CLED-agar). | I '''tabell 1''' visas växtsätt för sju olika referensstammar (bakterier och svamp) på tre standardsubstrat och Chromagar Orientation agar (BBL). Som framgår av tabellen var den prövade loten av kromagarn i stort sett likvärdig med referenssubstratet (CLED-agar). Ett av jästsvampisolaten växte bättre på kromagar än CLED, men enterokockerna något sämre. I en annan in vitro-prövning utförd i Västerås (2009) jämfördes CPS ID (bioMèrieux) mot CLED med 10 CCUG-stammar (presumtiva målbakterier för urinvägsdiagnostiken) beträffande växt (koloniantal, kolonistorlek, koloniutseende) och kolonifärg. ''E. faecalis'' växte genomgående med nära dubbla koloniantalet på det kromogena substratet jämfört med CLED. ''Staphylococcus aureus'' och ''Streptococcus agalactiae'' växte med mycket små kolonier, övriga (''E. coli, Klebsiella, Acinetobacter, Pseudomonas'') med medelstora eller stora kolonier. Färgomslagen överensstämde genomgående med fabrikantens beskrivningar. Resultaten av dessa jämförelser illustrerar vikten av att vid upphandling jämföra olika fabrikat av kromagar mot varandra och också mot referenssubstrat (CLED-agar). | ||
[[Fil:BKromogentabell.jpg|thumb|center|800px|]] | [[Fil:BKromogentabell.jpg|thumb|center|800px|]] | ||
Versionen från 13 februari 2012 kl. 13.12
Artikel publicerad december 2011. Texten är preliminär, ännu ej beslutad genom konsensusförfarande
Till artikeln Översikt fasta substrat för bakteriologiska odlingar
Kromogena substrat
Introduktion
Kommersiella kromogena fasta substrat för mikrobiologisk odlingsdiagnostik har funnits på marknaden i drygt 20 år och används i ökande omfattning på landets laboratorier. De saluförs både som färdiga plattor eller som dehydrerade medier för egen tillverkning. För diagnostik av jästsvampar rekommenderas kromagar som ett av referenssubstraten. För övrigt kan de i flera fall vara användbara alternativ eller komplement till referenssubstraten. Det är då viktigt att känna till de kromogena substratens fördelar och begränsningar jämfört med referenssubstraten. Eftersom kromogena substrat visualiserar målorganismer i olika distinkta kolonifärger kan man lättare urskilja dessa i blandfloror än med gängse medier. Med vana avläsare kan detta innebära högre diagnostisk känslighet. Även om det inte gäller generellt, kan slutlig diagnos ofta direkt ställas med rimligt hög specificitet utan ytterligare testning av organismerna, vilket kan innebära såväl tidsmässiga som ekonomiska vinster trots att substraten generellt är dyrare än standardsubstraten.
Kromogener är substanser som då de hydrolyseras av speciesspecifika mikrobiella enzymer frisätter en färgad, oftast atoxisk, produkt (Perry, J.D., Freydière, 2007). Denna är bunden till de enskilda kolonierna och diffunderar inte ut i det kringliggande mediet, vilket gör de kromogena substraten särskilt lämpade att skilja målorganismerna från övrig flora. Som kromogener används vanligen olika halogenderivat av indoxyl (exempelvis 5-bromo-4 kloro indoxyl) som i substratet kopplats till olika glykosider (exempelvis galaktosid eller glukuronid). Hydrolys av molekylerna via (species)specifika mikrobiella enzymer (exempelvis glukuronidas hos E. coli) frisätter indoxyl som i närvaro av syre ihopkopplas till dimerer. Beroende på vilka halogener som kopplats till indoxyl uppstår då olika, ofta intensiva färger. För detektion av beta-glukosidasbildande mikrober (exempelvis enterokocker och Streptococcus agalactiae) används ofta glykosiden eskulin som vid hydrolys bildar eskuletin vilket i sin tur tillsammans med järn bildar ett svart/brunt komplex. Andra substanser, som fenoler och alisarin (det senare beståndsdel i färgen krapplack), används också som kromogener i substrat. Tyvärr anger fabrikanterna sällan den exakta (patentskyddade) kompositionen av den kromogena mixen.
Det bör observeras att färgblindhet förekommer hos 8 % (män) och 1 % (kvinnor). Sådana individer kan ha svårigheter att skilja kolonifärgerna på de kromogena substraten (Odds, Bernaerts, 1994). Detta kan vara värt att uppmärksamma på laboratorierna i samband med placering av personal.
Substratkontroller
Inför upphandlingar av kromogena substrat, oavsett om de levereras som färdiga plattor eller som dehydrerade medier ska, enligt principerna för substratattestningar, ett antal fabrikat prövas mot varandra och också jämföras mot något av referenssubstraten (exempelvis CLED-agar när det gäller substrat för urindiagnostik). Det är lämpligt att jämföra growth index relativt referenssubstratet med viable count för ett antal nyckelorganismer. Viktigt är att bedöma allmänt koloniutseende och hur väl färgerna överensstämmer med de av leverantören angivna. De fortlöpande tillverkningstesterna kan ske med de av fabrikanten rekommenderade organismerna. Se för övrigt om substratkontroll i artiklarna Bilaga 2:Substratkontroll- Hud, mjukdelar, skelett och inre organ, 4. Substratkontroll-svamp, Kvalitetssäkring-diagnostik mage, tarm, Bilaga 1b. Substratkontroll, Urin-bilaga 1, Bilaga 1 Bakteriologiska substratrecept-NLI.
Användningsområden för kromogena substrat inom klinisk mikrobiologi
Urinodlingar
Ett antal fasta kromogena substrat marknadsförs som alternativ till gängse odlingssubstrat (CLED-, blod-, McConkey-agar). Kombinationen blodagar och kromogena substrat torde ge likvärdiga diagnostiska prestanda som kombinationen blod- och CLED-agar (Kvantitativ urinodling-hög rutinnivå (Nivå 2)). De kromogena substaten medger direkt presumtiv identifiering av E. coli, Klebsiella/Enterobacter/Serratia, Proteus/Morganella/Providencia och enterokocker. Med vissa fabrikat kan också S. saprophyticus identifieras presumtivt. Övriga grampositiva bakterier växer ofta sämre och ungefär som på CLED-agar. Specificiteten för identifiering av E. coli, P. mirabilis och enterokocker är allmänt hög oavsett fabrikat.
För alla fabrikat av kromogena medier rekommenderas inkubering aerobt, 35-37 °C.
I en studie publicerad 2002 (Aspevall et al) jämfördes referenssubstraten CLED, blod-agar och McConkey-agar, mot fyra kommersiella kromogena substrat (Chromagar Orientation från BBL, CHROMagar Orientation, CHROMagar, Chromogenic UTI Medium, Oxoid, och CPS ID, bioMérieux). Studien omfattade 1200 urinprov med totalt 420 kliniskt relevanta bakteriella isolat som bedömdes som kliniskt relevanta. Växten på de kromogena substraten var i nivå med referenssubstraten såväl kvantitativt som kvalitativt; efter ett dygn växte 99-100 % av isolaten på referenssubstraten mot 97-99 % på de kromogena. Efter 2 dygns inkubering var skillnaderna i växt i huvudsak kvar. I studien konstaterades att några av enterokockisolaten i blandkulturer bara kunde identifieras på de kromogena substraten och att antalet jästisoleringar blev färre med dessa substrat. Jämfört med standarddiagnostiska metoder identifierades E. coli korrekt i 95-99 % av fallen på de kromogena substraten, men ett av 5 Citrobacter species identifierades som E. coli. Författarna konkluderade att kromogena substrat kan användas som ensamt alternativ till CLED-agar (Kvantitativ urinodling-låg rutinnivå (screening, Nivå 1)) för isolering av uropatogener.
I en studie av Whittier och Della-Latta (2005) jämfördes resultat av odling av 785 urinprov på ett biplattsystem (blod/MacConkey) mot odling på Chromagar Orientation (BBL). Identiska positiva odlingsresultat erhölls i 355 prov, medan olika resultat erhölls i 21 fall (2,7 %). I endast sex av dessa bedömdes skillnaderna ha klinisk betydelse (blandfloror där man endast med kromagarn identifierade växt av enterokocker). Mellan 43 och 44 % (materialet åldersstratifierat) av resultaten på kromagar hade kunnat rapporteras direkt utan vidare testningar. Författarna konstaterade att nyttan med kromagar framförallt var att lättare kunna identifiera målbakterier i blandfloror och att direkt identifiering av vissa bakterier (främst E. coli och enterokocker) kunde bidra till minskat behov av verifierande biokemiska tester.
I tabell 1 visas växtsätt för sju olika referensstammar (bakterier och svamp) på tre standardsubstrat och Chromagar Orientation agar (BBL). Som framgår av tabellen var den prövade loten av kromagarn i stort sett likvärdig med referenssubstratet (CLED-agar). Ett av jästsvampisolaten växte bättre på kromagar än CLED, men enterokockerna något sämre. I en annan in vitro-prövning utförd i Västerås (2009) jämfördes CPS ID (bioMèrieux) mot CLED med 10 CCUG-stammar (presumtiva målbakterier för urinvägsdiagnostiken) beträffande växt (koloniantal, kolonistorlek, koloniutseende) och kolonifärg. E. faecalis växte genomgående med nära dubbla koloniantalet på det kromogena substratet jämfört med CLED. Staphylococcus aureus och Streptococcus agalactiae växte med mycket små kolonier, övriga (E. coli, Klebsiella, Acinetobacter, Pseudomonas) med medelstora eller stora kolonier. Färgomslagen överensstämde genomgående med fabrikantens beskrivningar. Resultaten av dessa jämförelser illustrerar vikten av att vid upphandling jämföra olika fabrikat av kromagar mot varandra och också mot referenssubstrat (CLED-agar).
Fecesodlingar
Salmonella: Flera kommersiella kromogena substrat finns tillgängliga för presumtiv identifiering av Salmonella men ännu inga för Shigella. De är generellt måttligt selektiva substrat (ungefär som McConkey-eller XLD-agar) ofta med ett kromogent substrat för beta-galaktosidas. På sådana substrat växer fecesflorans koliforma bakterier med blå-gröna eller blå-violetta kolonier medan Salmonella, som saknar beta-galaktosidas, växer med röda kolonier (typsubstrat Rambach-agar; via jäsning av propylenglykol). Andra kromogena Salmonella-substrat har glukuronsyra eller kromogent alfa-galaktosidas som indikator för målbakterierna. Under senare tid har substrat som detekterar specifika Salmonella-esteraser (exempelvis kromogenent magenta-kaprylat) blivit vanligare. Målbakterierna blir med dessa substrat ljust lila, purpur-eller magentafärgade. Även S. Typhi och S. Parathypi kan presumtivt identifieras på esterasbaserade medier.
Sensitivitet och specificitet hos de kromogena Salmonella-substraten tycks inte vara helt i paritet med referenssubstratens (XLD, DC). I en studie där testmediet hade kromogen alfa-galaktos (Perry et al 2002) konstaterades att bara drygt hälften av Salmonella-isolaten producerade alfa-galaktosidas. I en annan studie (Perry et al 2003) jämfördes fyra kromogena Salmonella-substrat mot Hektoen-agar. Känsligheten efter anrikning av fecesproven varierade för de kromogena substraten mellan 85,9 och 93,8 % mot 98,4 % för Hektoen-agar. Däremot var specificiteten hög (>91 % för alla kromogena substrat mot 78 % för Hektoen-agar). Författarna ansåg att framförallt de i studien ingående esteras-baserade medierna kunde rekommenderas för bruk i rutindiagnostik, eftersom dessa kunde minska behovet av differentierande biokemiska tester.
Nyttan av kromogent agarmedium för detektion av Salmonella i rutindiagnostiken är oklar. Referensmetodiken förutsätter att minimikriterier, baserade på biokemiska tester, skall vara uppfyllda för anmälan. Rutindiagnostiken också omfattar detektion av Shigella.
EHEC O157: Substrat för primärisolering av EHEC O157 bygger på principerna att bakterierna inte jäser sorbitol (SMAC-agar) eller att de saknar beta-glukuronidasaktivitet. Ett andra kromogent substrat (exempelvis för alfa-eller beta-galaktosidas) finns inkorporerade i vissa av fabrikaten. Visserligen har substraten generellt hög känslighet och specificitet för presumtiv påvisning av O157-bakterier, men inte för detektion av övriga EHEC-serotyper (Murinda et al. 2004). Behovet av dessa substrat är därför oklart.
Vibrio
Kromogena substrat finns för selektiv isolering av olika kliniskt relevanta Vibrio-arter (V. cholerae/V. vulnificus, V. parahaemolyticus, V. alginolyticus; CHROMagar Vibrio, BACTUS). Olika provmaterial kan användas, som pinnprov från sår (Nakashima et al 2007). Substratens eventuella roll i diagnostiken är oklar.
Staphylococcus aureus
Kromagar för detektion av S. aureus har funnits på marknaden i drygt 10 år. De har en känslighet jämfört med standardsubstrat (blod-agar) på drygt 95 %. Vissa fabrikat där kromogenen baseras på alfa-glukosidas har i studier uppvisat både hög känslighet (nära 97 %; S. aureus ID) och specificitet (>90 %, Perry et al 2003). Detta substrat inhiberar också effektivt enterokocker vilket kan vara en fördel i avläsningssituationen. Med inget av de kromogena substraten för S. aureus kan man avvara konfirmerande tester.
Svampodlingar
Ett antal kromogena substrat finns tillgängliga för detektion av jästsvamp i kliniska prover. De är i synnerhet lämpade för differentiering av olika svampar (blandfloror) i kliniska prov, vilket är huvudsyftet med att i referensmetodiken ange kromagar som ett av de primära referenssubstraten. Som kromogen används substrat för beta-hexosamidas som möjliggör presumtiv identifiering av Candida albicans (gröna kolonier). C. dubliniensis kan med vissa fabrikat misstas för C. albicans, även om de ger mer mörkt gröna kolonier än C. albicans. De olika kromagarfabrikaten (exempelvis BBL CHROMagar Candida, licencierat av CHROMagar, Paris, Frankrike) innehåller kromogener som substrat för artspecifika jästenzymer och tillåter differentiering av C. albicans, C. glabrata, C. fragilis och C. krusei med hög specificitet. I en in vitro-studie (Eraso et al, 2006) jämfördes Candida ID 2 (bioMerieux, ett kromogent substrat i första hand för identifiering av C. albicans som framträder med blåa kolonier, men också av blandfloror) mot CHROMagar Candida. Candida ID 2 kunde enligt författarna skilja C. albicans från C. dubliniensis genom olika blå schattering av kolonierna. Vi rekommenderar att i fall av invasiva infektioner konfirmerande tester utförs för definitiv diagnostik av jästsvamp som växer på kromogena medier.
För övrigt hänvisas till artikeln Odling och substrat-svamp
GBS
Fortfarande orsakar GBS ett antal invasiva neonatala early onset-infektioner. Smittan överförs till barnet via vagina hos koloniserade mödrar i samband med förlossningen. Oavsett vilket fast substrat som används för primäridentifieringen skall varje screeningsprov för GBS anrikas i särskild anrikningsbuljong. Olika fasta differentierande substrat finns tillgängliga, bland andra Islam-agar (modifierad som Grananda-medium) som bygger på egenskapen hos hemolytiska GBS-isolat att producera ett orange-färgat pigment. Både sensitivitet och specificitet blir lidande av att ickehemolytiska GBS-isolat producerar pigment, varför kromogena substrat för organismerna har utvecklats. Dessa har rapporterats ha högre känslighet än blod-agar och Granada-medium (Roure et al. 2006).
Kromogena substrat för detektion av antibiotikaresistenta bakterier i kliniska prov
Ett antal kromogena substrat finns tillgängliga för primärisolering och presumtiv identifiering av olika typer av antibiotikaresistens. Dessa baseras på kromogena media som gjorts selektiva genom tillsatts av antibiotika. Substrat finns (2011) för MRSA, VRE, ESBL, CTX-M och KPC. Generellt hänvisar vi till gällande referensmetodik avseende påvisande av antibiotikaresistenta bakterier (REF) och inget av substraten rekommenderas som referenssubstrat.
VRE: I en studie av Malhotra-Kumar et al 2009 presenterades resultaten av en jämförelse mellan fyra olika fasta substrat av vilka två var avsedda för selektiv isolering av glykopeptidresistenta enterokocker från fecesprov. Författarna konkluderade att de selektiva substraten fungerade bra med känslighetsnivåer på 98-99 %. Det skall observeras att nivån av vankomycin är 8 mg/L i flera kromogena substrat för VRE, vilket kan innebära att en del av låggradigt resistenta stammar kan missas med sådana substrat. I gällande referensmetodik[1] rekommenderas nivån 4 mg/L för optimal känslighet för isolering av enterokocker med vanB-gener.
MRSA: Ett antal kromogena substrat för detektion av MRSA finns tillgängliga. Över tid har olika selektiva antibiotika använts i dessa (meticillin, oxacillin, cefoxitin) varvid medier med cefoxitin uppvisat bäst känslighet, vilket möjligen kan förklaras av att den substansen inducerar PBP2´effektivare än de andra. Andra antibiotikakombinationer förekommer också och känsligheten avseende påvisande av MRSA i olika prover är med nyare medier mycket hög (>99 %, Perry and Freydière, 2007).
ESBL, CTX-M och KPC: Färdigberedda plattor eller supplement till kromagarfabrikat för påvisning av ESBL-producerande Enterobacteriaceae finns tillgängliga. Dessa innehåller olika antibiotikablandningar, exempelvis med cefpodoxim som ett av dessa, för att bli selektiva för ESBL-producerande bakterier. I en studie på fecesprover (Glupczynski et al, 2007) jämfördes det selektiva kromogena mediet ESBL-Bx, bioMérieux, med egentillverkade MacConkey-plattor med ceftazidim 2 mg /L. Känsligheten avseende påvisande av ESBL var 97.7 % för ESBL-Bx mot 84.1 % för de egentillverkade plattorna. Kromogena substrat marknadsförs också för selektiv isolering av CTX-M-ESBL. I en studie (Randall et al 2009) rapporteras ett sådant medium ha en känslighet motsvarande 100 % för selektiv isolering av Enterobacteriaceae med blaCTX-M-gen.
Selektiva kromogena substrat för rutinpåvisning av karbapenemasproducerande Enterobacteriaceae finns men används hittills endast i begränsad omfattning (Perry et al 2011). Dessa är ännu inte utvärderade avseende prestanda och behovet för humant bruk.
Länkar
REFERENSER
- 1. Perry, J.D. and Freydière, A.M. The application of chromogenic media in clinical microbiology. J Appl Microbiol 2007;103:2046-2055
- 2. Whittier, S. and Della-Latta, P. Evaluation of BBL CHROMagar Orientation Agar for Routine Urine Cultures in a High Volume Clinical Laboratory. As presented at the 105th General Meeting of the ASM, 2005.
- 3. Aspevall, O., et al. Performance of Four Chromogenic Urine Culture Media after One or Two Days of Incubation Compared with Reference Media. J Clin Microbiol. 2002:40;1500-1503
- 4. Svensson, C. Prövningsrapport, KML XII:15 CPS ID 3 Agar. Laboratoriemedicin, Klinisk mikrobiologi, Västerås Sjukhus. 2009
- 5. Perez, J.M., et al. Comparison of four chromogenic media and Hektoen agar for detection and presumptive identification of Salmonella strains in human stools. J Clin Microbiol. 2003;41:1130-1134.
- 6. Eraso, E., et al. Evaluation of the new chromogenic medium Candida ID 2 for isolation of and identification of Candida albicans and other medically importatnt Candida species. J Clin Microbiol. 2006;55:524-529.
- 7. Perry, J. D. et al Prevalence of faecal carriage of Enterobacteriaceae with NDM-1 carbapenemase at military hospitals in Pakistan, and evaluation of two chromogenic media. J Antimicrob Chemother. 2011;66:2288-94
- 8. Glupczynski , Y., et al. Evaluation of a New Selective Chromogenic Agar Medium for Detection of Extended-Spectrum β-Lactamase-Producing Enterobacteriaceae. J Clin Microbiol.2007:45;501-505
- 9. Odds, F.C., and R. Bernaerts. CHROMagar Candida, a new differentiated isolation medium for presumptive identification of clinically important Candida species. J Clin Microbiol 1994;32:1923-1929.
- 10. Perry, J.D. et al. Evaluation of S. aureus ID, a new chromogenic agar medium for detection of Staphylococcus aureus. J Clin Microbiol. 2003;41:5695-5698.
- 11. Murinda, S.E., et al. Phenotypic and genetic markers for serotype-specifik detection of Shiga toxin-producing Escherichia coli O26 strains from North America. Foodborne Pathog Dis 2004;1:125-135
- 12. Roure, C., et al. Prevention of perinatal group B streptococcal infections, evaluation of a new chromogenic medium STREPTO B ID. Abstract p798 in Abstracts of the 16th ECCMID, Nice, France.
- 13. Malhotra-Kumar, S., et al. Evaluation of culture-based approaches for rapid detection of glycopeptides-resistant enterococci: a randomized, investigator-blinded study. Abstract number 0251. ESCMID 2009
- 14. Randall, L.P., et al. Evaluation of CHROMagar CTX, a novel medium for isolating CTX-M-ESBL-positive Enterobacteriaceae while inhibiting AmpC-producing strains. J Antimicrob Chemother. 2009;63:302-308
- 15. Nakashima, Y., et al. A Chromogenic Substrate Culture Plate for early identification of Vibrio vulnificus and Isolation of other marine Vibrios. Ann Clin Lab Science. 2007;37:330-334