Adenovirus-sammanslagen artikel
Artikeln är sammanslagen januari 2013 från artiklar om adenovirus i CNS, NLI, ÖLI och ögon. Expertgranskad
Adenovirus
Smittämnet
Humana adenovirus hör till familjen Adenoviridae. De är medelstora, icke höljeförsedda lineärt dubbelsträngade DNA-virus med en diameter om 70-90 nm. Viruspartikeln består av en ikosahedral kapsid som omger arvsmassan på cirka 36 kbp med cirka 40 gener. Virus innehåller minst 10 proteiner varav vissa är gemensamma (hexon) och andra typspecifika. Adenovirus är hemagglutinerande. Denna egenskap medieras av 12 utskott (typspecifik fiber) från viruspartikelns hörn. Utskottens - fibernas - yttre del bär de typspecifika epitoperna. Femtiotvå serotyper av humana adenovirus har identifierats. Dessa indelas i sju subgrupper (species), A till G. Virus inom respektive species har distinkt skilda tropismer, vilket medför att adenovirus associeras med många olika kliniska syndrom. Ungefär hälften av de 52 adenovirustyperna ger upphov till sjukdom hos människa. Resterande typer är inte vanligt förekommande och tycks inte heller ha någon större patogen effekt, men kan kolonisera luftvägar och mag-tarm-kanal hos symptomlösa individer.
Virus är relativt stabilt och har förmåga att överleva länge i vatten och fuktiga miljöer. De är också relativt stabila mot kemiska dekontaminerande medel, men alkoholbaserad gel för handdesinfektion reducerar, om än långsamt, virus infektiositet.
Patogenes
Olika typer av adenovirus kan infektera epitelceller i luftvägar, ögon, urinvägar, tarm och genitalslemhinna. Infektionerna börjar med att virus binds till respektive målceller genom de virala fiberna och receptorer på cellytorna. Virus transporteras sedan in i cellen och når cellkärnan där virusreplikering sker. Från olika lokaler kan vissa adenovirus sprida sig till lymfoid vävnad och ge upphov till långvariga latenta infektioner i tonsiller och lymfkörtlar (species C). Primärinfektion sker vid inträdesporten, även i lymfatisk vävnad i svalget. Infektionen kan avgränsas lokalt eller ge upphov till viremi och generaliserad infektion med symtom även från CNS. Enteriska adenovirus infekterar enterocyter i gastrointestinalkanalen. Replikationscykeln omfattar ca 30 timmar. I motsats till icke tarmpatogena adenovirus utsöndras serotyperna 40 och 41 i stora mängder i feces. Utsöndring av adenovirus mätt med sedvanliga diagnostiska tekniker som EM, ELISA och virusodling kan kvarstå under flera månader upp till ett halvt år.
Klinik
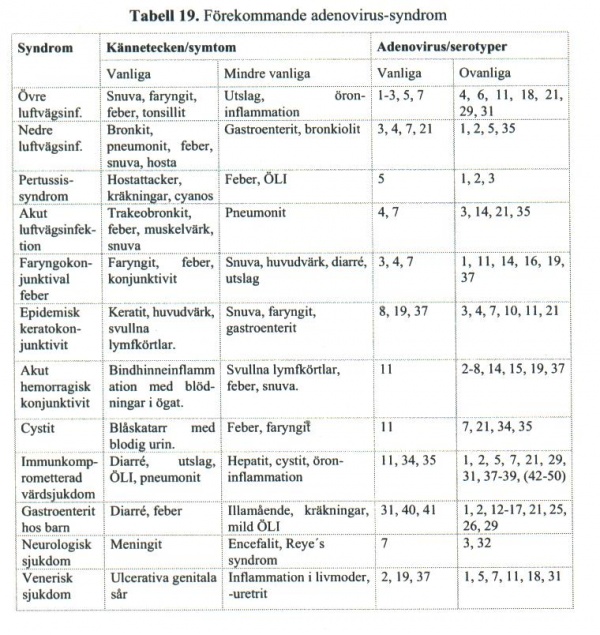
Kliniska syndrom associerade med olika typer av adenovirus listas i tabell 19.
Luftvägar: Adenovirus tillhörande species C (serotyp 1, 2 och 5) är endemiska virustyper som infekterar de allra flesta barn upp till 10 års ålder med övre luftvägsinfektion som följd. En karaktäristisk adenovirusinfektion orsakar hög feber med påtaglig faryngit, ofta med inslag av konjunktivit. Luftvägsinfektioner är oftast begränsade och inducerar en typspecifik immunitet följt av tillfrisknande.
Adenovirus kan också orsaka tonsillit som kliniskt svårligen kan skiljas från tonsillit orsakad av Streptococcus pyogenes. Ett flertal fall har beskrivits av akuta luftvägsinfektioner hos spädbarn och små barn inkluderande hög feber och hjärt- och lungsvikt. Dessa ofta dödliga förlopp har associerats med typer tillhörande species B; vanligtvis serotyp 7 och genomvarianter av denna typ.
Nedre luftvägsinfektioner förekommer som trakeit, pseudokrupp, bronkit och pneumoni.
Ögon: Keratokonjunktivit orsakas av virus inom species D, varvid serotyperna 3, 4 och 7 (Ad3, Ad4 och Ad7) är vanliga orsaker till ytlig follikulär konjunktivit, i synnerhet när dessa serotyper förekommer epidemiskt. Infektionen är som regel självbegränsande. Ibland är konjunktivit enda symtomet men presenteras oftast tillsammans med feber och halsont (faryngeokonjunktival feber) eller luftvägssymtom. Epidemisk keratokonjunktivit, har ett långdraget och besvärligt kliniskt förlopp och kan ge svår skada på hornhinnan som kan resultera i synnedsättning.
Mag-tarm-kanalen: Enteriska adenovirus som hör till serotyperna 40 och 41 (species F) är specifikt associerade med akuta gastroenteriter och är de näst efter rotavirus vanligaste orsakerna till diarré hos små barn. Durationen av symtom är betydligt längre än vid en akut rotavirhusinfektion; adenovirus serotyp 41-infektioner varar i genomsnitt ca 12 dagar medan serotyp 40-infektioner varar i 8-9 dagar. Dessutom är adenovirus-infektioner förknippade med mer buksmärta. Symtomen upphör spontant. Övriga adenovirus, som serotyp 1, 2, 3 ,5 och 31, kan ibland isoleras från feces men ger oftast mildare gastrointestinala symtom.
CNS: När adenovirusinfektioner engagerar CNS ses encefalit snarare än meningit. Denna orsakas av epidemiskt uppträdande adenovirustyper, i synnerhet adenovirus serotyp 7, som kan ge svåra encefaliter hos små barn. Encefalit kan även orsakas av de persiterande adenovirustyper som hör till species A och C både vid primär immundefekt och vid AIDS. Förekomsten av virusorsakad encefalit hos i övrigt friska barn belystes i en studie av 462 barn som genomfördes i Helsingfors. Barnen hade en medianålder av 6 år. Herpes simplex virus och Mycoplasma pneumoniae dominerade bland de infektioner som orsakade svåra följdtillstånd eller dödsfall. Därefter följde adenovirus och picornavirus som orsak till enstaka av dessa svåra fall.
Övriga och generaliserade infektioner: Adenovirus kan orsaka bland annat genital infektion, kardit, hepatit och hemmorragisk cystit. De kan också dra fördel av ett nedsatt immunförsvar och orsakar kvardröjande infektioner hos immunsupprimerade; infektioner som även kan ha ett dödligt förlopp. Särskilt allvarliga är infektioner med adenovirus i samband med hematopoietiska celltransplantationer.
Epidemiologi
Infektioner med adenovirus kan vara epidemiska, endemiska eller sporadiska. Adenovirustyper tillhörande species B: 1 (serotyp 3, 7, 16 och 21) och E (serotyp 4) kan uppträda epidemiskt. Smittspridning sker via luftburen droppinfektion, som vattenburen smitta eller genom kontaktsmitta. Intrafamiljär smittspridning är vanlig. Epidemiska utbrott av luftvägsinfektion (framförallt i skolor och militäranläggningar) orsakas främst av serotyp 3, 4, 7, 14 och 21. Nedre luftvägsinfektion, bronkit och pneumoni förekommer vid infektion med serotyp 3, 4, 7 och 21, undantagsvis också med endemiskt förekommande adenovirus av serotyp 1, 2, 5 och 35.
Smittspridning till ögon kan bland annat ske nosokomialt på ögonmottagning genom fingrar, ögondroppar eller instrument (exempelvis tonometer).
Behandling och prevention
Ingen effektiv specifik antiviral terapi riktad mot adenovirus finns tillgänglig. Vid svåra fall hos exempelvis immunsupprimerade kan antiviral terapi prövas, bäst effekt har tillskrivits cidofovir. Hos patienter med försvagat immunsvar kan det vid svår adenovirusinfektion också vara lämpligt, om så är möjligt, att minska på immunsupprimerande behandling.
Vaccin finns för prevention av luftvägsinfektioner orsakade av serotyperna 4 och 7, men marknadsförs inte i Sverige.
Provtagning, transport och svarsrutiner
- Luftvägsprov:
- Prov tas med provtagningspinne (eventuellt flockad pinne) fuktad med koksaltlösning från nasofarynx, svalg/tonsiller och transporteras i provtagningsrör till laboratoriet för immunfluorescens eller enligt särskilda anvisningar immunkromatografisk snabbtest. I förekommande fall kan prov tas från bronksköljvätska (BAL-prov). BAL-provet skickas som det är i sterilt rör. Det är lämpligt att vid luftvägsinfektion ta prov också från feces (se nedan).
- Prov för PCR-analys enligt [[1]]
- Ögon:
- Prov kan vid misstanke om keratokonjunktivit orsakad av adenovirus analyseras med PCR, odling eller antigenpåvisning. För PCR tas prov med fuktad pinne med steril koksaltlösning (eventuellt flockad pinne). Pinnen rullas mot nedre ögonlockets insida. Om provtagning från kornea är aktuell bör det provet tas av ögonläkare. Efter provtagning överförs pinnen till sterilt provtagningsrör och skickas till laboratoriet. I väntan på transport förvaras provet i kyla. Provet analyseras med PCR, och resultatet besvaras kvalitativt som positivt/negativt för adenovirus.
- För virusodling rekommenderas som för PCR prov som konjunktivalsvabb från nedre ögonlockets insida.
- Även för mikroskopi med antigenpåvisning med immunfluorescens rekommenderas konjunktivalsvabb. Före provtagningen rengörs ögat från pus. Celler från konjunktiva tas med en steril, torr bomullspinne som med ordentligt tryck rullas ca 3 varv mot nedre konjunktivalsäcken. Provet stryks sedan ut i cirkulära rörelser på förstansat objektglas (brunndiameter ca 10 mm). Minst tre brunnar bör fyllas. Låt glaset lufttorka. Provet transporteras i objektglaskasett till laboratoriet för fixering och färgning. Av största vikt för antigenpåvisningens sensitivitet är kvaliteten på insänt material. Rikligt cellantal är en förutsättning för god känslighet. I avvaktan på transport förvaras prov för virusisolering i +4 °C. Prov bör vara viruslaboratoriet tillhanda inom 24 timmar. Vid förväntad lång transporttid bör kyltransport (ej fryst!) övervägas.
- Prov för snabbtest med immunkromatografi tas enligt tillverkarens rekommendationer.
- Feces:
- Vid diarre med misstanke om infektion med adenovirus. Överför minst en ärtstor klick feces till transportröret. Sänd provet snarast till laboratoriet, senast inom 4 dygn från provtagningen. Vid lång transsporttid bör provet förvaras kylt.
- Det är lämpligt att vid luftvägsinfektion ta prov också från feces eftersom virus utsöndras under betydligt längre tid i feces än i luftvägssekret. Materialet används för antigendetektion eller PCR-analys. Resultatet besvaras kvalitativt som positivt/negativt för adenovirus.
- Prov från CNS:
- Vid disseminering av infektionen till CNS med misstanke om adenovirusinfektion: Csv överförs till sterilt provtagningsrör, lämplig provvolym är 1-2 mL. Transporteras omedelbart till laboratoriet. Provet analyseras med PCR. Resultatet besvaras kvalitativt som positivt/negativt för adenovirus.
- Generaliserade infektioner:
- Vid generaliserade infektioner, särskilt vid immunsuppression, kan virus-DNA påvisas i serum/plasma. I sådana fall rekommenderas ett rör EDTA-blod för PCR-analys. Prov kan skickas till laboratoriet som helblod (1-5 mL, den större volymen rekommenderas). I väntan på transport kylförvaras provet. Provet analyseras med kvantitativ PCR och besvaras positiv/negativ för adenovirus, antal kopior/mL.
- Serologi:
- Serologisk undersökning är ett alternativ. Adenovirusserologin är genusspecifik, ej typspecifik. Skicka akut- och konvalescentprov (5-10 mL venblod i vacuumrör utan tillsats, röd propp eller minst 2 mL serum).
- Urin:
- Prov kan skickas vid misstanke adenovirusinfektion, exempelvis vid hemmorragisk cystit. Rekommenderad provvolym är 5-10 mL(minsta volym 1 mL) urin. Sänd provet med ordinarie transport till laboratoriet, vid lång transsporttid förvaras provet kylt. Provet analyseras med kvantitativ PCR och besvaras positiv/negativ för adenovirus, antal kopior/mL.
Laboratoriediagnostik
Allmänt
Adenovirusinfektioner kan diagnosticeras genom virusisolering som historiskt varit referensmetodik för infektioner i CNS, nedre luftvägar och tarm, men också användbar metodik vid adenovirusinfektioner i övre luftvägar och ögon vid kvarstående misstanke vid negativt utfall av snabbtester. Verifiering av adenovirus i cellkultur kan ske med infärgning med fluorofor-konjugerade monoklonala antikroppar mot hexonprotein, en metod som också är användbar för diagnostik med mikroskopi av vävnad eller sekret. Den försvarar sin plats i den diagnostiska arsenalen främst genom möjligheten att identifiera serotyper. Odlingen har annars kommit att ersättas av nukleinsyrapåvisning som används för diagnostik av adenovirusinfektioner i CNS, nedre luftvägar och tarm. Metodiken är särskilt användbar för diagnostik av adenovirus hos immunsupprimerade, eller eljest hos sjukhusvårdade patienter med misstänkt adenovirusinfektion som pneumoni eller för övrigt på högriskpatienter.
Antigendetektion används också för diagnostik av adenovirus, framförallt vid diagnostik av ÖLI (nasofarynx, svalg) eller feces, antingen med EIA (hög sensitivitet och specificitet) immunfluorescens eller med snabbtest (immunkromatografi). De två sistnämnda testerna har begränsad sensitivitet (40-60 %), men har mycket hög specificitet (>99 %). Flera kit med monoklonala antikroppar som riktar sig mot typgemensamma epitoper, det vill säga påvisar adenovirus utan närmare specifikation, finns kommersiellt tillgängliga.
Även serologisk påvisning av antikroppar mot adenovirus är diagnostiskt alternativ, som dock kommit att användas i allt mindre omfattning, i dag nästan enbart för epidemiologiska kartläggningar eller som komplement vid ovanliga kliniska förlopp. Serologin har dock en viktig plats i diagnostiken när man vill förvissa sig om huruvida påvisat virus haft en patogenetisk roll eller enbart varit en oskyldig passagerare – detta gäller särskilt när virus påvisats i fecesprov.
Elektronmikroskopi anges som referensmetodik för påvisande av adenovirusinfektioner i mag-tarmkanalen, eftersom enteriska adenovirustyper är svåra eller omöjliga att propagera i cellkultur.
Serotypning av adenovirus sker med restriktionsenzymanalys eller PCR.
Referensmetodik
Virusisolering
Odling är historik referensmetod för påvisande av adenovirus i prov från Csv, svalg, konjunktiva, nedre luftvägar eller feces. Rollerkultur med företrädesvis A549-celler (human lungcancerlinje) används. Dessa celler är mottagliga för samtliga adenovirustyper utom Ad40 och Ad41, som med svårighet kan odlas på dem. Många adenovirustyper utvecklar en cytopatogen effekt först efter många dagars kultur, varför blindpassage alltid bör genomföras. Två typer av cytopatogen effekt uppträder vanligen efter 2-5 dagar; rundcellsdegeneration eller druvklasbildning. Den cytopatogena effekten av adenovirus tillhörande species A och D karaktäriseras av kraftigt upprundade celler. Druvklaseformation av infekterade celler karaktäriserar typer tillhörande species B, C och E. Rundcellsdegenerationen på A549-celler är till förväxling lik den vid herpes simplex-infektion. Druvklasbildningen är mer specifik för adenovirus och uppträder först i utlinjeringen av de hål i cellmattan som infektionen åstadkommer och i kanterna av cellmattan.
Adenovirusförekomst bekräftas med immunfluorescens eller latexagglutination. Man drar då nytta av att samtliga humana adenovirus delar ett gruppantigen som tidigare ofta påvisades via komplementbindning. Identifieringen av isolatet görs enkelt med en direktmärkt fluorescerande antikropp riktad mot hexonproteinet – den medger således inte serotypbestämning.
Övrig diagnostik
Antigendetektion
Antigendetektion är visserligen tämligen okänsligt vid direktpåvisning i prov från luftvägsprover eller konjunktiva, men har kommit att användas i allt större omfattning. Framförallt är det immunkromatografisk snabbtest som används på laboratorierna i landet. Hantering enligt tillverkares beskrivning. Känsligaste metodik är EIA, medan IFL har ungefär samma prestanda som immunkromatografisk metodik. Antigendetektionen lämpar sig väl för påvisning av antigen i feces och då särskilt av serotyperna 40/41, vilka kan utsöndras i stora mängder.
Nukleinsyrapåvisning
Adenovirus PCR-amplifiering har blivit allt viktigare som alternativ till odlingen. En konserverad region inom hexongenen i adenovirusgenomet används oftast som målgen, vilket innebär att alla serotyper av adenovirus kan amplifieras med ett och samma primersystem. För ökad känslighet används ofta en nestad PCR, vilket innebär att amplifieringen sker i två separata steg med olika primerpar. Detta har visat sig vara viktigt för påvisande av viruspartiklar i Csv vid adenovirusorsakad encefalit, eftersom koncentrationen av virus oftast är låg i denna kroppsvätska. Realtids-PCR har även börjat användas på laboratorier inom landet. Hos immunsupprimerade patienter kan adenovirusnivåerna följas med sådan teknik.
Information om speciestillhörighet kan erhållas genom ett PCR-förfarande som bygger på amplifiering av VA-RNA-generna. Dessa uppvisar en storlek som är karaktäristisk för varje species.
PCR-teknik finns utarbetad för påvisning av adenovirus i allmänhet och enteriska adenovirus (typ 40,41) i synnerhet (Bilaga 4.3). Utförs vid kliniskt virologiska laboratoriet i Umeå.
Serologi
Den klassiska komplementbindningsmetoden användes tidigare i Sverige för påvisande av ett immunsvar efter en adenovirusinfektion. För att säkerställa en infektion med metoden krävs akut- och konvalescentprov för att påvisa en signifikant titerförändring. Samma sak gäller för diagnostik med IgG-antikroppar med ELISA. Förhöjda titrar i enstaka prov kan indikera en nyligen genomgången infektion. Av IgM-påvisning mot adenovirus finns ingen större klinisk erfarenhet. Vid en primärinfektion, som ju drabbar alla under småbarnsåren, finns ett IgM-svar, medan reinfektioner med samma eller andra serotyper ger inget eller svagt IgM. Därför har IgM-påvisningen en mindre betydelse hos äldre barn och vuxna.
Elektronmikroskopi
Diagnostik av alla adenovirus kan ske med elektronmikroskopi eller med immunologiska tester som ELISA och latexagglutination. De enteriska adenovirustyperna är svåra eller omöjliga att propagera i cellkultur. Däremot påvisas övriga adenovirustyper ofta.
Epidemiologisk typning
Serotypning
Traditionell serotypning av adenovirus genomförs med neutralisationstest, som på grund av det stora antalet serotyper används i endast begränsad omfattning. Denna är tidskrävande och baseras på en kombination av virusodling på celler och neutralisering med typspecifika antikroppar. Det utförs endast på ett fåtal ställen i världen idag.
Genomkarakterisering
Olika typer av genomkarakterisering på DNA-nivå används i dag som ersättning för serotypning, och idag talar man oftare om genotyper (med olika genomvarianter) än serotyper. Fortfarande är dock serotypning central och vid införande av en ny adenovirustyp måste denna typ vara definierad som serotyp.
Karakterisering av adenovirustyper på genomnivå kan utföras på följande sätt :
- 1.Sekvensering av hela genomet.
- 2.Sekvensering av PCR-amplifierat fragment.
- 3.Restriktionsenzymanalys av hela genomet.
- 4.Restriktionsenzymanalys av PCR-fragment.
Metoderna 2-4 används idag i Sverige. Sekvensering av ett helt genom är tidskrävande och görs endast på forskningsnivå. Direktsekvensering av ett amplifierat och därmed begränsat fragment är snabbast och enklast. Det begränsas dock av att det i dagsläget bara finns runt 30 olika typspecifika hexonsekvenser tillgängliga i genbankerna att jämföra sin erhållna sekvens med. Framförallt för species D-gruppen saknas information och typning på detta sätt fungerar då ej fullt ut. Samma sak gäller för restriktionsenzymanalys av PCR-fragment. De 32 typer som tillhör species D går inte att skilja från varandra på grund av mycket hög DNA-sekvenshomologi i hexongenen. Att använda PCR-fragment som bas för typning av adenovirus kan vara lite motsägelsefullt. Först amplifieras en konserverad region upp som sedan skall vara måltavla för typspecifika olikheter. Trots detta går det med metod 4 att nästan fullständigt typa medlemmarna i övriga species. För fullständig typning på genomnivå används metod 3 då adenovirusspecifikt DNA prepareras för att i nästa steg klippas med olika restriktionsenzym. Genom att analysera klippt DNA på agarosgel går det att urskilja specifika bandmönster som är unika för varje typ. Med denna metod kan man även identifiera varianter av varje typ, så kallade genomvarianter. Det är oftast dessa varianter som figurerar ute i samhället beroende på att viruset har förändrat sig något sedan prototyperna, d.v.s. ursprungstyperna, isolerades och identifierades för första gången.
Kvalitetskontroll
Externa kvalitetspaneler för påvisande av adenovirus i feces finns att tillgå.
Svarsrutiner
Fynd av virus vid odling eller antigenpåvisning i infekterade celler är diagnostiskt relevant. Påvisande med odlingsteknik av adenovirus i kliniskt prov besvaras därför alltid. Påvisande av adenovirus med PCR-teknik bör framförallt avseende fecesprov tolkas med försiktighet eftersom ett antal apatogena adenovirus kan ge utslag i testerna.
Virusodling på ögonprov har god sensitivitet även om enstaka serotyper kan vara svårodlade (t ex Ad8). Antigenpåvisning har låg sensitivitet. Därför bör negativt utfall vid antigenpåvisning bedömas försiktigt.
Laboratorierapportering
Adenovirusinfektion är ej anmälningspliktig enligt smittskyddslagen. Dock är CNS-infektion med adenovirus anmälningspliktig enligt falldefinition Virala meningoencefaliter (exkl. TBE).
REFERENSER
- 1.Cardosa, M.J., S. Krishnan, P. Hooi Tio, D. Perera, and S. Chang Wong. 1999. Isolation of subgenus B adenovirus during a fatal outbreak of enterovirus 71-associated hand, foot, and mouth disease in Sibu, Sarawak. Lancet 354:987-991.
- 2.Mistchenko, A. S., J. F. Robaldo, F. C. Rosman, E. R. R. Koch, and A. Kajon. 1998. Fatal adenovirus infection associated with new genome type. J. Med. Virol. 54:233-236.
- 3.Pauschinger, M., N.E. Bowles, F.J .Fuentes-Garcia, V. Pham, U. Kuhl, P.L. Schwimmbeck, H.P. Schultheiss, and J.A. Towbin. 1999. Detection of adenoviral genome in the myocardium of adult patients with idiopathic left ventricular dysfunction. Circulation 10:1348-1354.
- 4.Hierholzer, J.C. 1992. Adenoviruses in the immunocompomised host. Clin. Microbiol. Rev. 5:262-274.
- 5.Walls, T., AG Shankar, and D. Shingadia. 2003. Adenovirus: an increasingly important pathogen in paediatric bone marrow transplant patients. Review in The Lancet Infectious Diseases. 3(2):79-86.
- 6.Heim, A., C. Ebnet, G. Harste, and P. Pring-Åkerblom. 2003. Rapid and quantitative detection of human adenovirus DNA by real-time PCR. J Med Virol 70:228-239.
- 7.Allard, A., B. Albinsson and G. Wadell. 2001. Rapid typing of human adenoviruses by a general PCR combined with restriction endonuclease analysis. J Clin Microbiol. 39:498-505.
- 8.Adrian, TH., G. Wadell, JC Hierholzer and R. Wigand. 1986. DNA restriction analysis of adenovirus prototypes 1 to 41. Arch. of Virology 91:277-290.
- 9.Svenungsson B et al. Enteropathogens in adult patients with diarrhea and healthy control subjects: A 1-year prospective study in a Swedish clinic for infections diseases. J. Clin Infect Dis 2000;30:770-778.
- 10.Uhnoo I et al. Importance of enteric adenoviruses 40 and 41 in acute gastroenteritis in infants and young children. J Clin Microbiol 1984;20:365-372.
- 11.Allard A, Wadell G. Polymerase chain reaction for the detection of adenovjruses In: Frontiers of Virology, ed. Becker Y, Darai G. Diagnosis of human viruses by polymerase chain reaction technology 1992; 297-315.
- 12.Allard A, Albinsson B, Wadell G. Detection of adenoviruses in stools from healthy persons and patients by two-step polymerase chain reaction. J Med Virol 1992;37: 149-157.
- 13.Allard A. Polymerase chain reaction for the detection of adenoviruses. In: Frontiers of Virology. Ed: Becker Y, Darai G, 2nd ed. 1996.
- 14.Hierhoizer JC. Adenoviruses in the immunocompromised host. Clin Microbiol Rev 1992;5:262-274.
- 15.Kidd AH, Jönsson M, Garwicz D, Kajon AE, Wermenbol AG, Verweij MW, de Jong JC. Rapid subgenus identification of human adenovirus isolates by a general PCR. J Clin Microbiol. 1996;34:622-627.
- 16.Rautonen J, Koskiniemi M, Vaheri A. Prognostic factors in childhood acute encephalitis. Pediatr Infect Dis 1991;i0:44l-446.