Skillnad mellan versioner av "Speciell epidemiologi-infektioner i mage och tarm"
| Rad 75: | Rad 75: | ||
De smittkällor som identifierats är opasteuriserad mjölk, kontakt med lantdjur, person till person smitta, bad i förorenat vatten och privatimporterad korv. Studier har visat att 1,2 % av svensk nötboskap är bärare av EHEC O157. | De smittkällor som identifierats är opasteuriserad mjölk, kontakt med lantdjur, person till person smitta, bad i förorenat vatten och privatimporterad korv. Studier har visat att 1,2 % av svensk nötboskap är bärare av EHEC O157. | ||
| − | + | [[Fil:Fecesfigur8.jpg]] | |
| − | |||
==== ''Kolera'' ==== | ==== ''Kolera'' ==== | ||
Versionen från 13 december 2009 kl. 18.45
Till innehållsförteckningen för Referensmetodik: Tarminfektioner, 2:a upplagan 2002
Speciell epidemiologi-infektioner i mage och tarm
Bakteriella infektioner
Salmonella
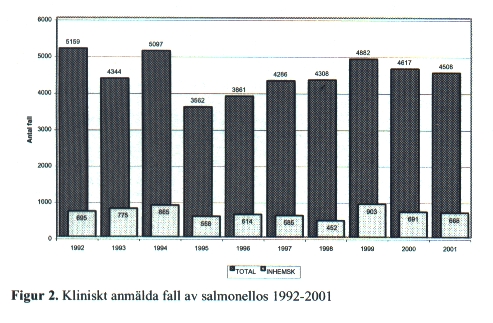
Salmonella har global utbredning och förekommer hos en mängd olika djur utan symtom. Bakterierna sprids huvudsakligen via livsmedel. De är mycket resistenta mot kyla och uttorkning och kan tillväxa i födoämnen, även vid förhållandevis låga temperaturer, men de överlever inte temperaturer över +70 0C. Symtomfria bärare med goda hygienvanor utgör en obetydlig smittrisk. Årligen rapporteras 4 000-5 000 nya humanfall [Fig. 2], varav ca 85 % smittats utomlands. Att notera är att antalet fall de två senaste åren i denna figur (och följande figurer) inte alltid motsvarar officiell rapportering från SMI. Anledningen är att principen för rapportering har ändrats sedan år 2000 så att alla, och inte bara den klinisk rapporten, nu registreras. För att staplarna ska vara jämförbara med tidigare år används den äldre principen varvid antalet fall blir något lägre. Bärarfrekvensen av Salmonella bland friska personer i industriländer har uppskattats till 0,1 % - 0,2 %.
Under den senaste tioårsperioden har cirka 130 olika serotyper per år diagnostiserats i vårt land. De två vanligaste är S. Enteritidis och S. Typhimurium. Varje år isoleras cirka tio nya serotyper som inte tidigare påvisats i landet. Dessa typer har i regel förvärvats utomlands.
Enligt en nyligen framlagd rapport från Socialstyrelsen diagnostiseras troligen endast 10-15 % av det faktiska antalet salmonellasmittade. Lindriga symtom och ej genomförd undersökning avseende salmonellaförekomst anges som tänkbara orsaker till mörkertalet. Möjliga brister i den bakteriologiska odlingsdiagnostiken uppmärksammas däremot endast i förbigående.
Antalet rapporterade fall av salmonellos har sjunkit sedan mitten av 1990-talet i övriga Europa och är bl.a. en följd av att råa ägg inte får användas i mat som skall serveras på restauranger, skolor, sjukhus m.m. Härigenom har även svenska turister undgått salmonellasmitta. Sverige har tack vare sin stränga salmonellalagstiftning inte behövt vidta sådana åtgärder och svenska ägg är salmonellafria. Under 1991 sågs dock en spridning i landet av Salmonella Enteritidis fagtyp 4 härstammande från en enda värphönsbesättning. Sveriges inträde i EU har inte medfört att antalet personer smittade från europeiskt kött ökat, vilket befarades innan folkomröstningen. Däremot har en harmonisering av importregler för reptiler medfört att sådana blivit lättillgängligare och många nyblivna reptilägare har smittats denna väg.
Djurbesättningar och livsmedel av animalt ursprung har i Sverige idag en, inter¬nationellt sett, unikt låg förekomst av Salmonella. Stora ansträngningar bör göras för att upprätthålla den mycket låga nivån (<0,1 %) Salmonella i råvaror och slaktdjur. Målsättningen är att såväl inhemskt producerade som importerade livsmedel ska vara fria från Salmonella.
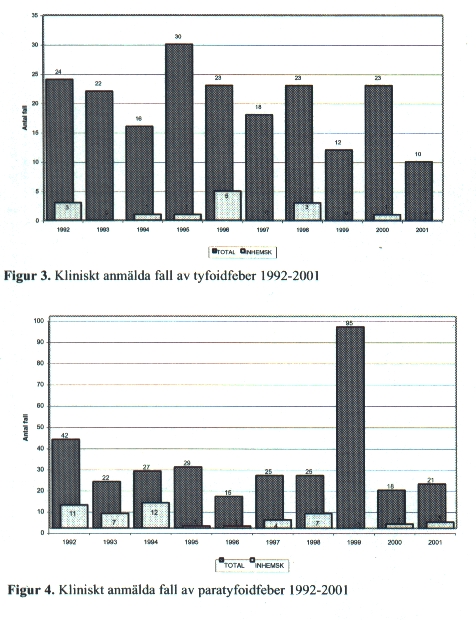
Tyfoid- och paratyfoidfeber
S. Typhi och S. Paratyphi har endast människa som reservoar. De rapporterade fallen av tyfoidfeber har varit ganska konstant under åren [Fig. 3]. Under 1999 noterades ett utbrott av paratyfoidfeber i den turkiska turistorten Alanya då 305 europeiska turister smittades varav 80 svenskar. De inhemska fall som inträffat har varit sekundärfall eller laboratoriesmitta.
Två olika vacciner mot tyfoid finns. Ett levande attenuerat och ett innehållande Vi-antigen.
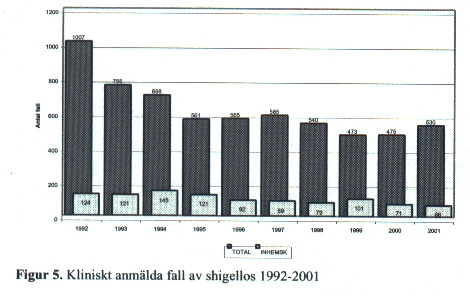
Shigella
Shigella har människa som huvudsaklig reservoar. Den låga infektionsdosen medför stor smittsamhet inte bara genom livsmedel och vatten utan också från person till person.
Rapporterade fall av shigella-infektion [Fig. 5] fortsätter att minska totalt. År 2001 rapporterades 530 fall. Normalt är ca 90 % utlandssmittade. Av de anmälda fallen 2001 med uppgift om smittland angavs 66 personer vara smittade i Sverige, vilket var det lägsta antalet inhemska fall under den senaste 10-årsperioden. En tydlig årstidsvariation syns bland fallen med en majoritet rapporterade under juli till oktober. Av de inhemska fallen syns en tydlig topp under september och oktober, beroende på den sekundära smittspridning som sker på daghem från barn som varit utomlands. Under 1994 orsakade importerad isbergssallad ett utbrott av shigella-infektion i landet med 50 rapporterade fall. Även andra länder i Europa fick shigellautbrott orsakade av denna spanska isbergssallad. I västvärlden dominerar infektioner med Shigella sonnei som oftast ger relativt mild sjukdom. De allvarligaste dysenterifallen orsakas av Shigella dysenteriae typ 1 (Shiga´s bacill).
Så länge bakterien kan påvisas i feces är patienten smittsam. Risken för smitta är dock störst i det akuta skedet. Efter 3 veckor är 50 % smittfria utan behandling. Man bör vara generös med antibiotikabehandling vid shigella-infektion eftersom sjukdomsförloppet här¬igenom förkortas. Personer med riskyrke samt förskolebarn bör behandlas omgående av epidemiologiska skäl.
Smittbärare med riskyrke får inte utföra sitt normala arbete. Förskolebarn som är smittbärare får inte vistas på daghem. Som riskverksamhet betraktas yrkesmässig beredning eller hantering av oförpackade livsmedel liksom yrkesmässig vård av spädbarn eller patienter med nedsatt immunförsvar
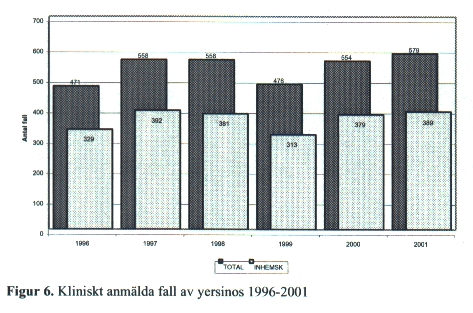
Yersinia
År 2001 rapporterades till SMI 579 fall med Y. enterocolitica varav flertalet var inhemskt smittade [Fig. 6]. En klar dominans ses för åldersgruppen under fem år. Smittvägen är oral. Främsta reservoaren finns hos grisar, men även hundar, katter och råttor kan bära smitta. Kunskapen om smittvägar är ofullständig, men viktigaste kända smittkällor är fläskkött och förorenad mjölk. Y. enterocolitica kan tillväxa vid temperaturer ner mot noll grader, således även vid kylskåpstemperatur. Smitta från person till person kan förekomma, liksom smitta från husdjur (hund, katt) till människa. Även blodtranfusionssmitta är beskriven.
Infektioner med Y. pseudotuberculosis drabbar främst djur och mera sällan människa. En av förklaringarna till detta kan vara att bakterien är svår att odla fram med den metodik som används vid de flesta laboratorier och att man därför inte diagnostiserar förekommande infektioner.
Campylobacter
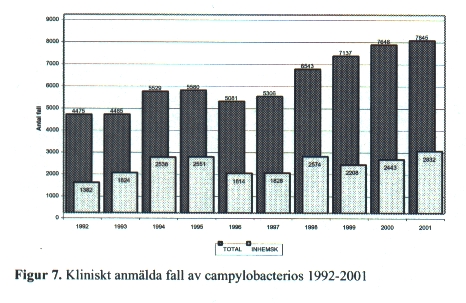
Campylobacter-infektion är sedan 1993 den mest frekvent rapporterade bakteriella diarrésjukdomen i landet [Fig. 7]. Även andelen inhemskt smittade personer är hög, >30 %, i kontrast till salmonella-infektion där cirka 15 % är inhemskt smittade. Dessa drygt 2 000 inhemska fall (2832 av 8577 år 2001) per år gör att det är angeläget att identifiera de olika smittkällorna för att förhindra vidare smittspridning. Kyckling har i många år utpekats som den viktigaste smittkällan i landet, men samtidigt som andelen smittade kycklingar minskat markant har antalet smittanmälda personer ökat vilket visar på fler smittkällor för Campylobacter än otillräckligt upphettat fågelkött. Övriga dokumenterade smittrisker är opasteuriserad mjölk, vatten direkt från fjällbäckar eller andra vattendrag, bristande hygien i kök samt spridning i familjer. Sedan 1 januari, 1996 skall full identitet anges på den kliniska anmälan för Campylobacter-infektion vilket väsentligt underlättar smittspårningen. Många mindre familjeutbrott identifieras också numera.
EHEC-Enterohemorragiska Escherichia coli
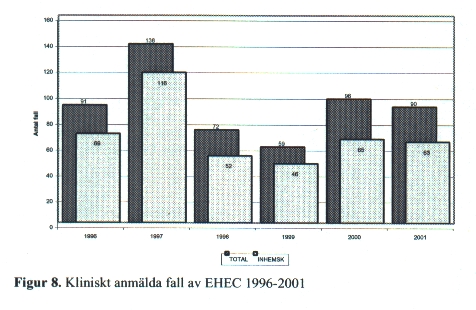
EHEC är en "ny" patogen då mycket få fall rapporterades före år 1995 [Fig 8]. Sjukdomen orsakas av E. coli med förmåga att bilda shigatoxin. Under hösten 1995 hade Sverige sitt första utbrott av EHEC något som inte var förvånande med tanke på hur situationen under många år varit i Storbritannien, framförallt Skottland. EHEC är den tarminfektion som orsakar flest dödsfall bland barn i den industrialiserade världen. Under 5 % av alla fall utvecklar hemolytiskt uremiskt syndrom (HUS) vilket är ett livshotande tillstånd. Effektiv behandling mot EHEC saknas och man får inrikta sig på att behandla de komplikationer som uppstår. Majoriteten av de som sjuknar är barn under 5 års ålder.
Sedan den 1 januari 1996 ingår EHEC O157 bland de smittsamma sjukdomar som skall anmälas enligt smittskyddslagen. Även andra serotyper kan orsaka kolit och HUS men har hittills inte inkluderats i smittskyddslagen trots att de som tillhör O121:H19, O26:H11 och O103:H2 förknippats med utbrott.
De smittkällor som identifierats är opasteuriserad mjölk, kontakt med lantdjur, person till person smitta, bad i förorenat vatten och privatimporterad korv. Studier har visat att 1,2 % av svensk nötboskap är bärare av EHEC O157.
Kolera
Kolera är en huvudsakligen vattenburen smitta. Dess epidemiologi kännetecknas av explosiva utbrott som ofta startar i flera distinkta foci samtidigt och sprider sig över världen som pandemier, vilka kan fortgå i åratal. De sex första pandemierna har utgått från Gangesdeltat, den första 1817. Den sjunde stora pandemin av typ O1 El Tor, började 1961 i Indonesien och nådde Peru i Syd¬amerika 1991. Därefter uppträdde 1992, först i Indien sedan i Bangladesh, en ny serogrupp, O139 "Bengal" i epidemisk form.
Personer med akut kolera utsöndrar mellan 10e7 och 10e13 organismer per gram avföring. Många insjuknar inte alls eller endast med milda symtom och fungerar som reservoarer för vidare spridning. Kolerabakterier kan också kolonisera zooplankton och epidemier har kopplats samman med sådan blomning.
Infektion med klassisk V. cholerae medför immunitet medan skyddet efter infektion med biotyp El Tor är svagare.
Tillgängliga vaccin består av avdödade helcells/toxoid preparationer eller hel¬cellsberedningar av levande försvagade stammar för oralt bruk.
Ett fåtal fall har rapporteras i Sverige under den senaste tioårsperioden. De flesta har smittats utomlands men fall av laboratoriesmitta har också förekommit.
Helicobacter pylori
Helicobacter pylori är en vanlig orsak till gastrit. I Skandinavien uppskattas 30-40 % av hela befolkningen vara infekterad och i vissa invandrargrupper är pre¬valensen ännu högre. Smitta sker ofta under barnaåren och i Nordeuropa förvärvar årligen ca 1 % av förskolebarnen H. pylori-infektion. På grund av bättre levnadsförhållanden har incidensen minskat under de senaste decennierna och den kommer sannolikt att fortsätta minska. Det finns inga reservoarer för H. pylori påvisade utanför människa. (Information från Läkemedelsverket 1996; 7:23).
Clostridium difficile
Clostridium difficile förekommer sannolikt i den normala tarmfloran hos de flesta människor, dock oftast i så små mängder att speciella anrikningsmetoder måste användas för att kunna påvisa den. Med rutinmetoder kan C. difficile påvisas hos endast 2-4 % av friska vuxna, jämfört med cirka 70 % av spädbarn (< 1år) hos vilka bakterien ofta förekommer i stora mängder. Signifikansen av att påvisa C. difficile hos små barn är därför tveksam. I motsats till förhållandet hos vuxna, förefaller intestinaltrakten hos små barn dessutom i de flesta fall vara opåverkbar av C. difficile-toxin, även om fall av pseudomembranös kolit (PMC) i späd ålder finns beskrivna. Asymtomatiskt bärarskap förekommer, framför allt hos äldre sjukhusvårdade patienter.
Fall av C. difficile-medierad sjukdom är ett nosokomialt problem som har ökat under de senaste åren. Om detta är resultat av ökad antibiotikaanvändning, sämre vårdhygien, en utökad laboratoriediagnostik, eller en kombination av flera faktorer är oklart. Organismen är i Sverige idag den vanligaste orsaken till in¬hemsk bakteriell diarré (> 5 000 fall/år) och även den vanligaste orsaken till nosokomial bakteriell diarré. Vid PMC, som är den minst vanliga formen av C. difficile-sjukdom, är mortaliteten ca 20 %.
Antibiotikabehandling är den i särklass viktigaste riskfaktorn när det gäller C. difficile-diarré. Cirka 30 % av antibiotikaassocierad kolit/diarré orsakas av C. difficile. Andra predisponerande faktorer är hög ålder, (flertalet patienter är över 64 år), underliggande sjukdom, t.ex. malignitet, njurinsufficiens, sjukhusvistelse, tarmkirurgi, ventrikelsond och cytostatikaterapi. Vid de svåra kolitfallen föreligger oftast flera av riskfaktorerna samtidigt.
Bakteriell resistensutveckling
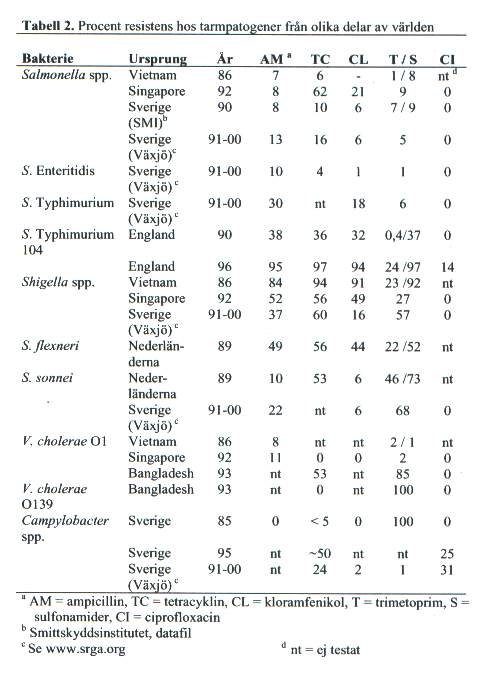
Av de antibiotika som kommit till användning vid tarminfektioner har resistens mot ampicillin, kloramfenikol, trimetoprim sulfa och kinoloner särskilt uppmärksammats [Tabell 2]. Resistensgenerna är ofta plasmidmedierade och uppträder tillsammans. De bakterier som bär tre eller fler olika resistensgener benämns multiresistenta. Hos Salmonella species och Shigella species är multiresistenta stammar ett vanligt och ökande fenomen, särskilt i utvecklingsländer men även i den industrialiserade delen av världen. Den senaste utvecklingen hos non typhi Salmonella-bakterier gäller multiresistenta isolat som dessutom förvärvat resistens mot kinoloner, trots att kinolonresistens ännu ej visats vara överförbar. Rapporter från England beskriver detta som ett problem hos både djur och människa, särskilt som de resistenta stammarna också tycks vara mer virulenta. Campylobacter är en annan tarmpatogen där resistens mot kinoloner ökat snabbt under senare år, sannolikt på grund av det i många länder utbredda bruket av kinoloner vid uppfödning av kyckling. Orsaken till kinolonresistens hos Campylobacter species är densamma som hos andra bakterier, nämligen en mutation i genen som kodar för enzymet DNA gyras, vilket är angreppspunkten för kinoloner. Hos Vibrio cholerae O1 har resistens mot flera av ovan nämnda antibiotika påträffats. I den senast beskrivna epidemin i Sydöstasien av V. cholerae O139 visade sig resistens mot trimetoprim/sulfa och streptomycin vara överförbar via ett genetiskt element som integrerats i kromosomen. Diarré orsakad av toxinbildande Clostridium difficile är ett exempel på störningar i tarmfloran som följd av antibiotikaanvändning. Clostridium difficile är en bakterie som är naturligt resistent mot många antibiotika och som därmed har en överlevnadsfördel vid långvarig antibiotikabehandling
Parasitinfektioner
Blastocystis hominis
Smittvägen har ej kunnat bevisas experimentellt men B. hominis överförs troligen den fekala-orala vägen. B. hominis är en vanligt förekommande organism världen över, så även i Sverige, där en daghemsstudie visade på en hög prevalens (7 av 51 barn) oavsett tidigare utlandsvistelse (Lebbad et. al.). Sambandet med gastrointestinala infektioner har ifrågasatts. Blastocystis spp. finns beskrivna hos en mängd olika djurarter men det är ej klarlagt om dessa organismer är B. hominis eller andra species.
Balantidium coli
Smittan överförs direkt genom fekal-oral kontakt via händer infekterade med cystor från svinfeces eller genom intag av kontaminerad föda eller förorenat vatten. Infektion hos människa är ovanlig och förekommer mest i varmt klimat i områden med låg hygienisk standard. I industrialiserade länder med kallare klimat är svinuppfödare och veterinärer riskgrupper. Epidemisk spridning mellan människor kan etablera sig om låg personlig hygien föreligger.
Cryptosporidium parvum
Cryptosporidium-oocystor är mycket motståndskraftiga mot olika desinfektionsmedel och kan liksom Giardia-cystor överleva i klorerat dricksvatten. De vanligaste smittvägarna är kontakt med infekterade djur, person till person smitta eller via infekterat vatten eller genom föda. Cryptosporidium parvum förekommer globalt, men är vanligast i områden med dålig omgivningshygien. Undersökning av råvatten till svenska reningsverk visade att 32 % av proverna innehöll misstänkta Cryptosporidium-oocystor. Varje år rapporteras mellan 30 -100 fall av kryptosporidios till SMI.
Cyclospora cayetanensis
Infekterade personer utsöndrar osporulerade (ej infektiösa) oocystor med feces, vilket gör person till person smitta osannolik. Oocystorna sporulerar efter en till två veckor och smittan överförs indirekt via kontaminerad föda eller genom vatten. Det finns ingen känd djurreservoar för Cyclospora. Sedan mitten av 1980-talet har Cyclospora förekomst rapporterats från de flesta delar av världen. I USA har utbrott rapporterats i samband med konsumtion av hallon och basilika.
Dientamoeba fragilis
Troligaste smittväg är fekal-oral smitta, något som dock ifrågasatts då känt cyststadium saknas och trofozoiten snabbt förstörs utanför kroppen. Transmission via Enterobius vermicularis (springmask) ägg infekterade med Dientamoeba fragilis har också föreslagits. Utbredningen är global. En studie från ett barnsjukhus i Kanada visar att D. fragilis var det vanligaste parasitfyndet under en femårsperiod. En svensk daghemsstudie visade att Dientamoeba fragilis var en vanligt förekommande parasit med 8/51 barn infekterade (Lebbad 1998).
Entamoeba histolytica
Människa är den enda reservoaren för Entamoeba histolytica. Cystor av E. histolytica sprids via vatten eller föda. Cystorna överlever klorering men avlägsnas vanligtvis från dricksvattnet med sandfiltrering.
E. histolytica förekommer i hela världen, men är endast endemisk i områden med dålig omgivningshygien. Av världspopulationen beräknas 3-10 % vara infekterade. Enligt en WHO-rapport från 1998 orsakar amöbainfektion ca 70 000 dödsfall om året. Av protozoinfektionerna är amöbiasis den fjärde ledande dödsorsaken efter malaria, Chagas´ sjukdom och leishmaniasis.
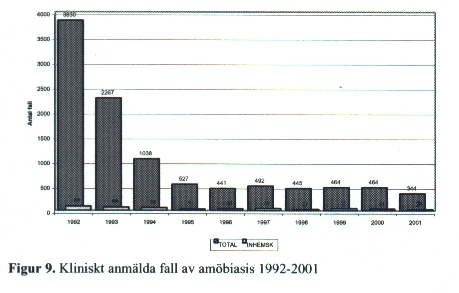
År 2001 anmäldes 344 fall av Entamoeba histolytica till SMI men 90-95 % av dessa är antagligen E. dispar, se vidare i speciell del. Endast ett fåtal av dessa har smittats inom landet och det är främst sekundärfall till utlandssmittade men även sexuell smittöverföring rapporteras. Toppen 1992 – 93 återspeglar ett stort antal asylsökande [Fig. 9].
Giardia intestinalis
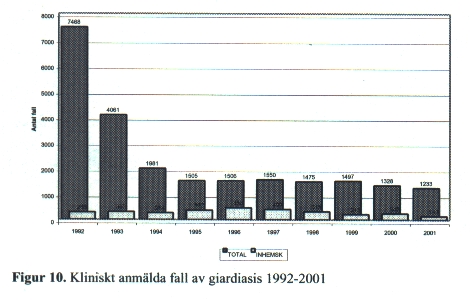
Cystorna är mycket motståndskraftiga mot olika desinfektionsmedel och kan överleva i klorerat dricksvatten. Smittan överförs via intag av vattenburna cystor eller genom direkt kontakt med en infekterad person. Morfologiskt identiska parasiter finns hos husdjur och vilda däggdjur men transmission mellan djur och människa är ännu inte fastställd och det är ovisst om Giardia från djur kan smitta en människa. Giardia-infektion förekommer endemiskt i områden med låg hygienisk standard, sprider sig mellan barn på daghem och är vanlig hos resenärer. Den kan också förekomma i vattenburna utbrott efter avloppsförorening av kommunalt dricksvatten. De senaste fyra åren har cirka 1 400 kliniska fall/år rapporterats till SMI [Fig. 10]. Av dessa har majoriteten smittats utomlands. De inhemska fallen beror till stor del på smittspridning bland barn på daghem.
Isospora belli
Infekterade individer utsöndrar oocystor med feces. I motsats till Cryptosporidium är oocystorna ej infektiösa omedelbart efter utsöndring vilket gör person till person smitta sällsynt. Sporuleringen tar ett till två dygn och resulterar i mogna infektiösa oocystor med två sporocystor. Dessa för smittan vidare via infekterad föda eller vatten. Isospora belli förekommer främst i tropiska och subtropiska delar av världen och är endemisk i delar av Sydamerika, Afrika och Sydostasien.
Microsporidia
Innan 1985, då Enterozytozoon bieneusi beskrevs första gången var endast en handfull fall av human mikrosporidia-infektion rapporterade. Sedan dess har mikrosporidiafall beskrivits från i stort sett hela världen inklusive Sverige (Svedhem 1998), de flesta i form av E. bieneusi-infektioner hos aids-patienter. Introduktionen av antiviral behandling har resulterat i ett kraftigt minskat antal fall av aids-relaterad mikrosporidia-infektion (Conteas 1998). Mikrosporidios orsakad av såväl E. bieneusi som E. intestinalis har också upptäckts i enstaka fall hos immunkompetenta individer, då i samband med självläkande diarré (Svenungsson 1998). Inget fynd av microsporidia ingick i den frivilliga laboratorierapporteringen 1998-2000.
Virusinfektioner
I Sverige uppträder diarrésjukdomar orsakade av rotavirus, calicivirus och astrovirus huvudsakligen under vinterhalvåret medan infektioner orsakade av adenovirus förekommer året runt. Upp till 10e9–10e10 viruspartiklar utsöndras i kräkningar och i feces hos akut sjuka patienter samtidigt som den dos som orsakar sjukdom beräknas vara så låg som 10-100 partiklar, vilket förklarar den mycket snabba spridning som kan ses på daghem, i skolor, på sjukhusavdelningar och andra institutioner som vårdar patienter. Generellt utsöndras virus i feces så länge gastrointestinala symtom föreligger, vilket aktualiserar kravet på relevant provtagning. Fecesprov för virus/virusantigen påvisning skall tas när patienten har symtom. Smittspridningen är fekal-oral. Samtliga virus som orsakar gastrointestinala symtom är mycket motståndskraftiga mot olika desinfektionsmedel och infektiösa partiklar kan överleva 1-2 veckor på ytor som ett dörrhandtag eller leksaker i ett väntrum på en barnavdelning.
Rotavirus
Rotavirus är den vanligast förekommande patogenen hos yngre barn med akut gastroenterit. Nosokomiala infektioner med rotavirus är vanliga på barn- och geriatriska avdelningar. I Sverige uppträder diarrésjukdomar orsakade av rotavirus huvudsakligen under vinterhalvåret. Rotavirus indelas i undergrupper och grupperna A-C har identifierats hos människa.
Grupp A rotavirus är den vanligast förekommande undergruppen. Mellan 1500-1700 barn sjukhusvårdas årligen i landet p.g.a. en akut rotavirus grupp A infektion. Rotavirus grupp A infektioner är också associerade med en signifikant mortalitet främst i u-länder där ca 600 000 dödsfall inträffar per år. Enstaka dödsfall förekommer även i Sverige.
Grupp B rotavirus har hittills endast påvisats i Kina och Indien.
Grupp C rotavirus har isolerats i Sverige och har i en svensk prospektiv undersökning bland vuxna med diarrésjukdom visats förekomma hos 1/3 av de 3 % som med elektronmikroskopi visades utsöndra rotavirus.
Flera vacciner mot rotavirus grupp A infektioner har prövats med varierande resultat. Kliniska prövningar pågår för närvarande med åtminstone två tänkbara orala attenuerade vaccinkandidater, en genrekombinerad bovin rotavirusstam och en human rotavirus stam av serotyp 1. Lovande resultat i fas 2 prövningar före¬ligger.
Calicivirus
Calicivirus är den viktigaste orsaken till nosokomiala och födoämnesburna diarréutbrott i Sverige. Ca 200 diarréutbrott/år diagnostiseras vid SMI med hjälp av elektronmikroskopi. En majoritet av dessa utbrott visar sig vara utlösta av calicivirus tillhörande gruppen Norwalk-liknande virus. De diarréutbrott som uppträder på sjukhus resulterar i stora praktiska vårdproblem med stängningar av vårdavdelningar och orsakar därmed höga samhällskostnader. Calicivirus drabbar individer i alla åldrar. Calicivirus kan påvisas i kontaminerat vatten, frusna bär, bageriprodukter, sallad och skaldjur. Infektioner med calicivirus uppträder främst under vinterhalvåret.
Astrovirus
Astrovirus orsakar gastroenterit främst hos yngre barn men även institutionsvårdade äldre individer. Astrovirus är orsaken i 1-6 % av barn inlagda med en akut diarrésjukdom. Astrovirus kan förorsaka såväl epidemiska utbrott som sporadiska fall. Ett flertal internationella epidemiologiska studier visar att antikroppar riktade mot astrovirus uppträder tidigt i barndomen och vid 5 års ålder har ~70 % av barnen antikroppar mot astrovirus. Inga svenska studier föreligger. Astrovirus infektioner uppträder främst under vinterhalvåret.
Enteriska adenovirus
Adenovirus 40 och 41 har i Sverige identifierats hos sjukhusvårdade barn med diarrésjukdom i en frekvens av 8 % och i olika internationella studier 4-15 %. Vid tre års ålder har 30-100 % av barn neutraliserande antikroppar riktade mot adenovirus 40 och 41. Adenovirus infektioner förekommer endemiskt året om.
REFERENSER
- Lebbad M, Nääs J, Tjernström K. Parasiter på daghem. Svenska Läkarsällskapets Riks¬stämma, 24-26 november 1998, Göteborg.
- Conteas C N, Berlin O G, Speck C E, Pandhumas S S, Lariviere M J, Fu C. Modification of the clinical course of intestinal microsporidiosis in acquired immunodeficiency synd¬rome patients by immune status and anti-human immunodeficiency virus therapy. Am J Trop Med Hyg 1998;58:555-558.
- Smittsamma sjukdomar 2001. Årsrapport från avdelningen för epidemiologi. SMI tryck 136-2002
- Svedhem V, Lebbad M, Struve J, Veress B, Andström E, Aust-Kettis A, Linder E. Microsporidia in duodenal biopsies from 72 HIV-infected patients with ab¬dominal com¬plaints. APMIS 1998;106:535-538.
- Svenungsson B, Capraru T, Evengard B, Larsson R, Lebbad M. Intestinal microsporidiosis in a HIV-seronegative patient. Scand J Infect Dis 1998;30:314-316.